В какой системе одновременное увеличение давления
Содержание статьи
Химическое равновесие. Принцип Ле Шателье
Материалы портала onx.distant.ru
Понятие химического равновесия
Признаки химического равновесия
Принцип Ле Шателье
Влияние температуры на химическое равновесие
Влияние давления на химическое равновесие
Влияние концентрации на химическое равновесие
Константа химического равновесия
Примеры решения задач
Задачи для самостоятельного решения
Равновесным считается состояние системы, которое остается неизменным, причем это состояние не обусловлено действием каких-либо внешних сил. Состояние системы реагирующих веществ, при котором скорость прямой реакции становится равной скорости обратной реакции, называется химическим равновесием. Такое равновесие называется еще подвижным или динамическим равновесием.
- Состояние системы остается неизменным во времени при сохранении внешних условий.
- Равновесие является динамическим, то есть обусловлено протеканием прямой и обратной реакции с одинаковыми скоростями.
- Любое внешнее воздействие вызывает изменение в равновесии системы; если внешнее воздействие снимается, то система снова возвращается в исходное состояние.
- К состоянию равновесия можно подойти с двух сторон — как со стороны исходных веществ, так и со стороны продуктов реакции.
- В состоянии равновесия энергия Гиббса достигает своего минимального значения.
Влияние изменения внешних условий на положение равновесия определяется принципом Ле Шателье (принципом подвижного равновесия):
Если на систему, находящуюся в состоянии равновесия, производить какое-либо внешнее воздействие, то в системе усилится то из направлений процесса, которое ослабляет эффект этого воздействия, и положение равновесия сместится в том же направлении.
Принцип Ле Шателье применим не только к химическим процессам, но и к физическим, таким как кипение, кристаллизация, растворение и т. д.
Рассмотрим влияние различных факторов на химическое равновесие на примере реакции окисления NO:
2NO(г) + O2(г) → 2NO2(г); ΔHо298 = — 113,4 кДж/моль.
При повышении температуры равновесие сдвигается в сторону эндотермической реакции, при понижении температуры — в сторону экзотермической реакции.
Степень смещения равновесия определяется абсолютной величиной теплового эффекта: чем больше по абсолютной величине энтальпия реакции ΔH, тем значительнее влияние температуры на состояние равновесия.
В рассматриваемой реакции синтеза оксида азота (IV) повышение температуры сместит равновесие в сторону исходных веществ.
Сжатие смещает равновесие в направлении процесса, который сопровождается уменьшением объема газообразных веществ, а понижение давления сдвигает равновесие в противоположную сторону.
В рассматриваемом примере в левой части уравнения находится три объема, а в правой — два. Так как увеличение давления благоприятствует процессу, протекающему с уменьшением объема, то при повышении давления равновесие сместится вправо, т.е. в сторону продукта реакции — NO2. Уменьшение давления сместит равновесие в обратную сторону. Следует обратить внимание на то, что, если в уравнении обратимой реакции число молекул газообразных веществ в правой и левой частях равны, то изменение давления не оказывает влияния на положение равновесия.
Для рассматриваемой реакции введение в равновесную систему дополнительных количеств NO или O2 вызывает смещение равновесия в том направлении, при котором концентрация этих веществ уменьшается, следовательно, происходит сдвиг равновесия в сторону образования NO2. Увеличение концентрации NO2 смещает равновесие в сторону исходных веществ.
Катализатор одинаково ускоряет как прямую, так и обратную реакции и поэтому не влияет на смещение химического равновесия.
При введении в равновесную систему (при Р = const) инертного газа концентрации реагентов (парциальные давления) уменьшаются. Поскольку рассматриваемый процесс окисления NO идет с уменьшением объема, то при добавлении инертного газа равновесие сместится в сторону исходных веществ.
Для химической реакции:
2NO(г) + O2(г) → 2NO2(г)
константа химической реакции Кс есть отношение:
Кс = [NO2]2/([NO]2 · [O2]) (1)
В этом уравнении в квадратных скобках — концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, т.е. равновесные концентрации веществ.
Константа химического равновесия связана с изменением энергии Гиббса уравнением:
ΔGTо = — RTlnK (2)
Задача 1. При некоторой температуре равновесные концентрации в системе 2CO (г) + O2 (г)→2CO2 (г) составляли: [CO] = 0,2 моль/л, [O2] = 0,32 моль/л, [CO2] = 0,16 моль/л. Определите константу равновесия при этой температуре и исходные концентрации CO и O2, если исходная смесь не содержала СО2.
Решение.
2CO(г) + O2(г) →2CO2(г)
Вещество | CO | O2 | CO2 |
| Сисходн, моль/л | 0,52 | 0,48 | |
| Спрореагир,моль/л | 0,32 | 0,16 | 0,16 |
| Сравн, моль/л | 0,2 | 0,32 | 0,16 |
Во второй строке под Спрореагир понимается концентрация прореагировавших исходных веществ и концентрация образующегося CO2, причем, Сисходн= Спрореагир + Сравн.
Задача 2. Используя справочные данные, рассчитайте константу равновесия процесса
3 H2 (г) + N2 (г) →2 NH3 (г) при 298 К.
Решение.
ΔG298о = 2·(- 16,71) кДж = -33,42·103 Дж.
ΔGTо = — RTlnK.
lnK = 33,42·103/(8,314× 298) = 13,489. K = 7,21× 105.
Задача 3. Определите равновесную концентрацию HI в системе
H2(г) + I2(г) →2HI(г),
если при некоторой температуре константа равновесия равна 4, а исходные концентрации H2 , I2 и HI равны, соответственно, 1, 2 и 0 моль/л.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л H2.
| Вещество | H2 | I2 | HI |
| сисходн., моль/л | 1 | 2 | |
| спрореагир., моль/л | x | x | 2x |
| cравн., моль/л | 1-x | 2-x | 2x |
Тогда, К = (2х)2/((1-х)(2-х))
Решая это уравнение, получаем x = 0,67.
Значит, равновесная концентрация HI равна 2× 0,67 = 1,34 моль/л.
Задача 4. Используя справочные данные, определите температуру, при которой константа равновесия процесса: H2(г) + HCOH(г) →CH3OH(г) становится равной 1. Принять, что ΔНоТ » ΔНо298, а ΔSоT » ΔSо298.
Решение.
Если К = 1, то ΔGоT = — RTlnK = 0;
ΔGоT = ΔНо298 — ТΔ Sо298 .
ΔНо298 = -202 — (- 115,9) = -86,1 кДж = — 86,1× 103 Дж;
ΔSо298 = 239,7 — 218,7 — 130,52 = -109,52 Дж/К;
0 = — 86100 — Т·(-109,52)
Т = 786,15К
Задача 5. Для реакции SO2(Г) + Cl2(Г) →SO2Cl2(Г) при некоторой температуре константа равновесия равна 4. Определите равновесную концентрацию SO2Cl2, если исходные концентрации SO2, Cl2 и SO2Cl2 равны 2, 2 и 1 моль/л соответственно.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л SO2.
SO2(г) + Cl2(г) →SO2Cl2(г)
| Вещество | SO2 | Cl2 | SO2Cl2 |
| cисходн., моль/л | 2 | 2 | 1 |
| cпрореагир., моль/л | x | x | х |
| cравн., моль/л | 2-x | 2-x | x + 1 |
Тогда получаем:
(х + 1)/(2 — х)2 = 4
Решая это уравнение, находим: x1 = 3 и x2 = 1,25. Но x1 = 3 не удовлетворяет условию задачи.
Следовательно, [SO2Cl2] = 1,25 + 1 = 2,25 моль/л.
1. В какой из приведенных реакций повышение давления сместит равновесие вправо? Ответ обоснуйте.
1) 2 NH3 (г) → 3H2 (г) + N2 (г)
2) ZnCO3 (к) → ZnO(к) + CO2 (г)
3) 2HBr (г) → H2 (г) + Br2 (ж)
4) CO2 (г) + C (графит) →2CO (г)
Так как увеличение давления благоприятствует процессу, протекающему с уменьшением количества газообразных веществ, то равновесие сместится вправо в реакции 3. |
2. При некоторой температуре равновесные концентрации в системе:
2HBr (г) →H2 (г) + Br2 (г)
составляли: [HBr] = 0,3 моль/л, [H2] = 0,6 моль/л, [Br2] = 0,6 моль/л. Определите константу равновесия и исходную концентрацию HBr.
3. Для реакции H2(г) + S(г) →H2S(г) при некоторой температуре константа равновесия равна 2. Определите равновесные концентрации H2 и S, если исходные концентрации H2, S и H2S равны, соответственно, 2, 3 и 0 моль/л.
4. Используя справочные данные, вычислите температуру, при которой константа равновесия процесса
CO2(г) + C(графит) →2CO(г)
становится равной 1. Примите, что ΔНоТ≈ΔНо298, а ΔSоT≈ΔSо298
5. Используя справочные данные, рассчитайте константу равновесия процесса:
С2Н4(г) →С2Н2(г) + Н2(г)при 298 К
6. Для реакции 2С3Н8(г) → н-С5Н12(г)+СН4(г) при температуре 1000 К константа равновесия равна 4. Определите равновесную концентрацию н-пентана, если исходная концентрация пропана равна 5 моль/л.
7. При температуре 500 К константа равновесия процесса:
СО2(г) + 3Н2(г) → СН3ОН(г) + Н2О(г)
равна 3,4·10-5. Вычислите Δ Gо500.
8. При температуре 800 К константа равновесия процесса н-С6Н14(г)+ 2С3Н6(г)+Н2(г) равна 8,71. Определите ΔGоf,800(С3Н6(г)), если ΔGоf,800(н-С6Н14(г)) = 305,77 кДж/моль.
9. Для реакции СО(г) + Cl2(г) →СO2Cl2(г) при некоторой температуре равновесная концентрация СO2Cl2(г) равна 1,2 моль/л. Определите константу равновесия данного процесса, если исходные концентрации СО(г) и Cl2(г) равны соответственно 2,0 и 1,8 моль/л.
10. При некоторой температуре равновесные концентрации в системе 2SО2(г) + О2(г) →2SO3(г) составляли: [SО2 ]=0,10 моль/л, [О2]=0,16 моль/л, [SО3]=0,08 моль/л. Вычислите константу равновесия и исходные концентрации SО2 и О2.
К=4,0; исходная концентрация SО2 составляет 0,18 моль/л; исходная концентрация О2 составляет 0,20 моль/л. |
Источник
Тест по теме «Химическое равновесие»
Химическое равновесие
Вариант 1
1. Химическое равновесие в системе
2NO(г) + O2 (г) = 2NO2 (г) + Q
смещается в сторону образования продукта реакции при
1) повышении давления
2) повышении температуры
3) понижении давления
4) применении катализатора
2. Состояние химического равновесия характеризуется
1) прекращением протекания прямой и обратной химической реакций
2) равенством скоростей прямой и обратной реакций
3) равенством суммарной массы продуктов суммарной массе реагентов
4) равенства суммарного количества вещества продуктов суммарному количеству вещества реагентов
3. При изменении давления химическое равновесие не смещается в реакции
1) СО(г) + Сl2 (г) ↔ СОСl2 (г)
2) СО2(г) + С↔ 2СО(г)
3) 2СО(г) + О2(г) ↔2СО2(г)
4) С + О2 (г) ↔СО2(г)
4. Введение катализатора в систему, находящуюся в состоянии динамического равновесия
1) увеличит скорость только прямой реакции
2) увеличит скорость только обратной реакции
3) увеличит скорость как прямой, так и обратной реакции
4) не оказывает влияние на скорость ни прямой, ни обратной реакции
5. Давление не влияет на состояние химического равновесия следующей химической реакции
1) 2SO2 + O2 ↔ 2SO3
2) 3Н2 + N2 ↔ 2NH3
3) CO + Cl2 ↔ COCl2
4) Н2 + Cl2 ↔ 2HCl
6. Химическое равновесие в системе
2СО(г) ↔ СО2 (г) + С(т)+ 173 кДж
можно сместить в сторону продуктов реакции при
1) повышении давления
2) повышении температуры
3) понижении давления,
4) использовании катализатора
7. В какой системе увеличение давления и понижение температуры смещает химическое равновесие в сторону продуктов реакции?
1) 2SO2(г) + O2(г) ↔ 2SО3(г) + Q
2) N2(г) + О2(г) ↔ 2NO(г) — Q
3) CO2(г) + 2C(тв.)↔2CO(г) — Q
4) 2NH3(г) ↔N2(г) + 3H2(г) — Q
8. Изменение давления оказывает влияние на смешение равновесия в системе:
1) 2SO2(г) + О2(г) ↔2SO3(г)
2) СО(г) + Н2О(г) ↔ СО2(г) + Н2(г)
3) 2НI(г) ↔ Н2(г) + I2(г)
4) N2(г) + О2(г) ↔2NO(г)
9. При одновременном повышении температуры и понижении давления химическое равновесие сместится вправо в системе
1) Н2(г) + S(тв) ↔ H2S(г) + Q
2) 2NH3(г) ↔ N2(г) + 3Н2(г) — Q
3) 2SО2(г) + О2(г) ↔ 2SО3(г) + Q
4) 2HC1(г) ↔H2(г) + Cl2(г) — Q
10. На смешение химического равновесия в системе N2 + 3Н2↔2NH3 + Q
не оказывает влияния
1) понижение температуры
2) повышение давления
3) удаление аммиака из зоны реакции
4) применение катализатора
11. Давление не влияет на равновесие в реакции
1) N2(г) + 3H2 (г) ↔ 2NH3(г)
2) N2(г) + О2(г) ↔2NO(г)
3) С(тв) + СО(г) ↔2СО(г)
4) СО2(г) + Н2О(ж) ↔ H2CО3(p-p)
12. В равновесной системе
С(т) + Н2О (г) ↔ Н2(г) + СО(г) — Q равновесие сместится в сторону исходных веществ при:
1) повышении температуры и повышении давления
2) понижении температуры и повышении давления
3) повышении температуры и понижении давления
4) понижении температуры и понижении давления
13. В реакции
C3H6(г) + H2О(г) ↔ C3H7OH(г) + Q увеличить выход пропанола можно:
1) повысив давление
2) повысив температуру
3) понизив концентрацию Н2О
4) применив катализатор
Критерии оценки:
11-13 баллов — «5»,
8-10 баллов — «4»,
5-7 баллов — «3»
Химическое равновесие
Вариант 2
1. Обратимая химическая реакция
1) гидролиз сложного эфира
2) горение дров
3) варка мяса
4) затвердевание цемента
2. Для увеличения выхода сложного эфира в химическом процессе
C2H5OH + CH3COOH ↔ CH3COOC2H5 +H2O — Q
необходимо:
1) добавить воды
2) уменьшить концентрацию уксусной кислоты
3) увеличить концентрацию эфира
4) увеличить температуру
3. При понижении давления химическое равновесие смещается в сторону
1) эндотермической реакции
2) экзотермической реакции
3) уменьшения объема реакционной смеси
4) увеличения объема реакционной смеси
4. Химическое равновесие сместится в одну сторону при повышении давления и понижении температуры в системе:
1) N2 + 3Н2 ↔2NH3 + Q;
2) Н2 + Cl2↔ 2HC1 + Q;
3) N2 + О2↔ 2NO — Q;
4) С2H2(г)↔ 2С + Н2 — Q.
5. При понижении давления химическое равновесие смещается в сторону исходных веществ в системе
1) 2CO(г) +O2(г) ↔2CO2(г) + Q
2) N2(г) + O2(г) ↔2NO(г) — Q
3) SO2Сl2(г) ↔SO2(г) + Cl2(г)- Q
4) H2(г) + Cl2(г) ↔ 2HCl(г) + Q
6. Химическое равновесие в системе
FeO (т) + Н2(г) ↔Fe(т) + Н2О (г) — Q
сместится в сторону продуктов реакции при:
1) повышении давления
2) понижении давления
3) повышении температуры
4) использовании катализатора
7. При повышении давления равновесие смешается вправо в системе:
1) 2СО2(г) ↔ 2СО(г) + О2(г)
2) C2H4(г) ↔ С2Н2(г) + Н2(г)
3) РС13(г) + С12(г) ↔ РС15(г)
4) Н2(г) + С12(г) ↔2НС1(г)
8. Обратимой реакции соответствует уравнение
1) КОН + НС1 ↔ KCI + Н2О
2) N2 + 3Н2 ↔ 2NH3
3) FeCl3 + 3NaOH ↔ Fe(OH)3 + 3NaCl
4) Na2О + 2HCI ↔ 2NaCl + H2О
9. Химическое равновесие в системе
С4Н10 (г)↔С4Н8 (г) + Н2(г) — Q
можно сместить в сторону продуктов реакции
1) повышением температуры и повышением давления
2) повышением температуры и понижением давления
3) понижением температуры и повышением давления
4) понижением температуры и понижением давления
10. Химическое равновесие в системе
СО2 + С(тв) ↔ 2СО(г) — Q
сместится вправо при
1) повышении давления
2) понижении температуры
3) повышении концентрации СО
4) повышении температуры
11. В реакции С3Н6(г) + Н2(г) ↔С3Н8(г) + Q
увеличить выход С3Н8 можно:
1) повысив температуру
2) применив катализатор
3) понизив концентрацию водорода
4) повысив давление
12. Равновесие сместится в сторону продуктов реакции при повышении температуры и понижении давления в системе
1) Fe2О3(тв) + СО(г) ↔ 3FeO(тв) + CО2(г) + Q
2) С(тв) + СО2(г) ↔ 2СО(г) — Q
3) 2SО2(г) + О2(г) ↔2SО3(г) + Q
4) H2(г) + I2(г) ↔2HI(г) — Q
13 . Смещению равновесия в сторону образования исходных веществ в системе
4NО2(г) + 2Н2О(ж) + О2(г) ↔4HNО3(р-p) + Q
способствует:
1) повышение температуры и повышение давления
2) понижение температуры и повышение давления
3) понижение температуры и понижение давления
4) повышение температуры и понижение давления
Критерии оценки:
11-13 баллов — «5»,
8-10 баллов — «4»,
5-7 баллов — «3»
Источник
Химическое равновесие
Химическое равновесие — состояние химической системы, при котором скорость прямой реакции равна скорости обратной.
В большом количестве заданий, которые мне довелось увидеть, я ни один раз видел, как коверкают это определение. Например, в заданиях верно-неверно предлагают похожий вариант, однако говорят о «равенстве концентраций исходных веществ и продуктов» — это грубая ошибка. Химическое равновесие — равенство скоростей.
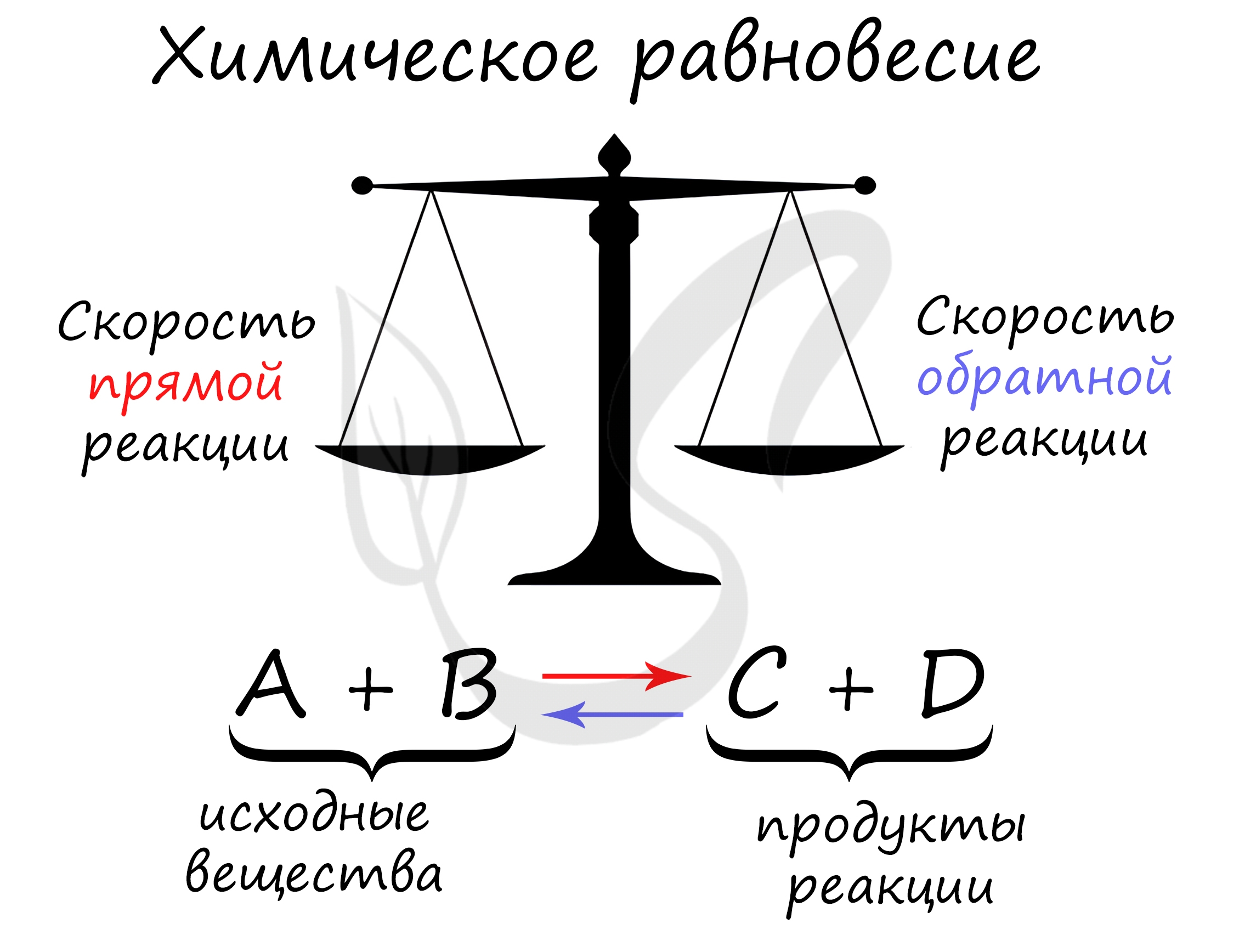
Принцип Ле Шателье
В 1884 году французским химиком Анри Ле Шателье был предложен принцип, согласно которому, если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию), то система будет стремиться компенсировать внешнее воздействие.

Это принцип обоснован термодинамически и доказан. Однако в такой абстрактной формулировке его сложно применить для решения конкретных задач по химическому равновесию. В этой статье я покажу конкретные примеры и обозначу алгоритм действия, чтобы вы могли успешно справляться с заданиями.
Влияние изменения концентрации на химическое равновесие
При увеличении концентрации какого-либо компонента химической реакции, система будет стремиться восстановить равновесие: равновесие будет смещаться в сторону расходования добавленного компонента.
Объясню проще: если вы увеличиваете концентрацию вещества, которое находится в левой части, равновесие сместится в правую сторону. Если добавляете вещество из левой части (продуктов реакции) — смещается в сторону исходных веществ. Посмотрите на пример ниже.

Если мы попытаемся удалить какое-либо вещество из системы (уменьшить его концентрацию), то система будет стремиться заполнить «пустое» место, которые мы создали. Наглядно демонстрирую на примере:
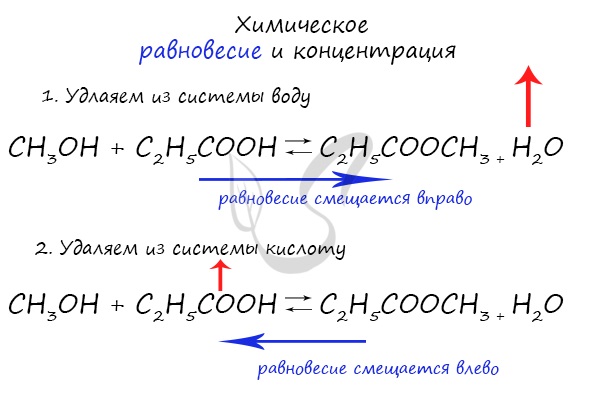
Можно подвести итог полученным знаниям таким образом: «Куда добавляем — оттуда смещается, откуда берем — туда смещается». Воспользуйтесь этой или придумайте свое правило для запоминания этой закономерности 😉
Изменения давления и химическое равновесие
Если речь в задании идет об изменении давления, то первое, что нужно сделать, это посчитать количество газов в уравнении слева и справа. Твердые вещества и жидкости считать не нужно. Например:
CO2(г) + С(тв) ⇄ 2CO(г) — Q
В приведенном уравнении количество молекул газа в левой части — 1, в правой — 2.
Запомните правило: «При увеличении давления равновесие смещается в сторону меньших газов, при уменьшении давления — в сторону больших газов». Для нашей системы правило действует таким образом:

В случае, если слева и справа количество молекул газа одинаково, например, в реакции:
H2(г) + I2(г) ⇄ 2HI(г) — Q
Слева — 2 газа, и справа — 2. В такой реакции увеличение или уменьшение давления не повлияет на химическое равновесие.
Изменение температуры и химическое равновесие
Если в задании увеличивают или уменьшают температуру, то первое, что вы должны оценить: экзотермическая это реакция или эндотермическая.
Следуйте следующему правилу: «При увеличении температуры равновесие смещается в сторону эндотермической реакции, при уменьшении — в сторону экзотермической реакции». У любой обратимой реакции есть экзо- и эндотермические части:
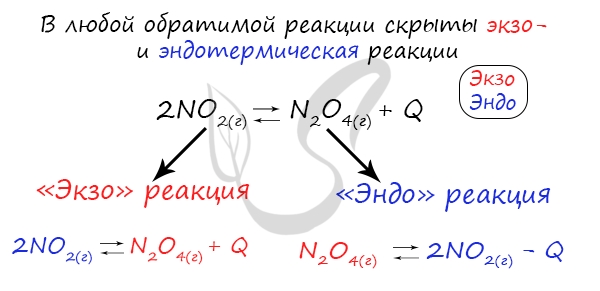
Поэтому данное правило универсально и применимо для всех реакций. Для примера разберем следующие задачи:

Чтобы не осталось белых пятен, возьмем экзотермическую реакцию и повторим с ней подобный эксперимент.
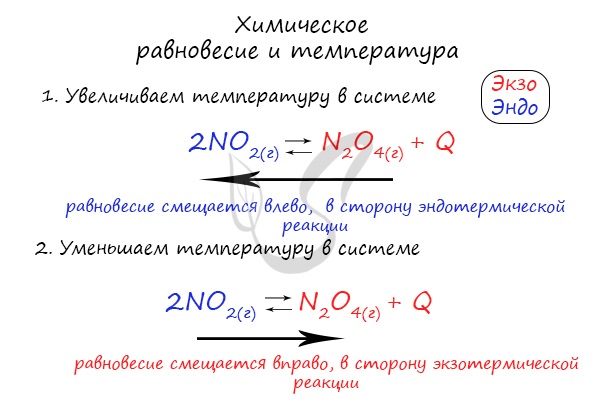
Катализатор и ингибитор
Действие катализатора и ингибитора соответственно касается только ускорения и замедления химической реакции. Они никоим образом не влияют на равновесие.
Константа равновесия
Константой равновесия называют отношения скоростей прямой и обратной реакции. Для реакции типа aA + bB = cC + dD константа равновесия будет записана следующим образом:

Решим задачу. Дана реакция: 2NO + Cl2 ⇄ 2NOCl . Вычислите константу равновесия, если равновесные концентрации веществ для данной реакции: c(NO) = 1.8 моль/л , c(Cl2) = 1.2 моль/л , c(NOCl) = 0.8 моль/л.

Константу равновесия для данной задачи можно представить в виде 1.64 * 10-1.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник