В каких условиях интенсивнее образование нитрозосоединений в продуктах
Содержание статьи
Образование канцерогенных нитрозосоединений из предшественников, содержащихся в пище и питьевой воде
К N-нитрозосоединениям относятся вещества типа:
в которых R — алкильный радикал, a R´ — может иметь любое строение, включая эфирные, амидо и ароматические группы.
Общей у таких соединений является только аминогруппа, в связи с чем физические свойства и биологическая активность могут варьировать. Большинство испытанных нитрозосоединений (НС) оказывает выраженное канцерогенное действие на лабораторных животных разных видов, что дает основание предполагать их бластомогенность и для человека.
Многолетние исследования Друкрея, Пройссмана и сотрудников показали, что избирательный синтез НС может привести к созданию канцерогенов, поражающих практически все органы экспериментальных животных. Опасность НС связана также с их мутагенным и трансплацентарным действием, а некоторые представители этой группы соединений способны вызывать токсическое поражение печени, почек, нервной системы и других органов животных.
В 1963 г. Друкрей и соавторы (Druckrey е. а., 1963) высказали предположение о возможности синтеза канцерогенного НС из предшественников — нитрита и амина.
Экспериментальные доказательства такого эндогенного синтеза впервые представили Сандер и Швайнзберг (Sander, Schweinsberg, 1972). В настоящее время установлена возможность синтеза in vitro или in vivo некоторых НС из предшественников — вторичных и третичных аминов, алкил или ариламидов — и нитрозирующих агентов — нитрита, нитрозгазов (NО и NО2) или нитратов, способных восстанавливаться в нитриты. Наиболее легко нитрозируемыми классами соединений являются слабощелочные вторичные амины (морфолин, пиперазин, N-метиланилин и др.), третичные (например, аминопирин), N-алкилмочевины и N-алкилкарбаматы.
В хронических опытах обнаружен бластомогенный эффект при введении животным нитрита в сочетании с N-метилбензил амином, метил и этилмочевиной, 1,3-диметилмочевиной, 2-ими-дазолидоном, N-метиланилином, лекарственными препаратами — аминопирином, пиперазином, морфолином, некоторыми пестицидами и другими соединениями (Mirvisch, 1975а).
Перед нами стоит задача оценить распространенность в пище человека нитратов, нитритов и аминов (амидов), возможность и условия образования из них в организме канцерогенных НС, а также обсудить, представляет ли эндогенный синтез последних опасность для человека.
«Питание, канцерогены и рак»,
Б.Л. Рубенчик
В настоящее время установлено, что бластомогенные НС могут содержаться в различных пищевых продуктах (см. обзоры: Sebranek, Cassens, 1973; Crosby, Sawyer, 1976). ДМНА, ДЭНА и другие НС обнаруживали в ячмене, пшенице, шпинате, бобах, в сыре и молоке, а также в свежих, консервированных и копченых мясных и рыбных продуктах в количествах от нескольких микрограммов до десятков миллиграммов…
В копченом и консервированном мясе иногда содержится значительное количество фенолов (до 300 мг/кг), что в присутствии нитритов создает потенциальные условия для образования нитрозофенолов (Knowes е. а., 1974). При нагревании до 130 — 170° С мяса или рыбы, к которым добавляли глицерин, саркозин или пролин и избыток нитрита натрия, образуются НС (в мг/кг продукта). При обработке лецитина…
Имеются указания на то, что избыточное использование нитратных удобрений, обработка растений гербицидом 2,4-дихлорфеноксиуксусной кислотой, дефицит молибдена в почве приводят к накоплению нитратов в растениях и фураже, что вызывает метгемоглобинемию у телят. Показана корреляция между дефицитом молибдена в огородных культурах и раком пищевода в областях Транскеи. При этом в растениях обнаружен ДМНА (Lijinsky, Epstein, 1970). Вторичные и…
Поскольку нельзя избежать действия на организм человека нитратов (нитритов) и аминов, необходимы поиски путей, позволяющих сделать это влияние менее опасным. Однако из наиболее реальных направлений профилактики — снижение уровня нитритов в пищевых продуктах. Добавление их при консервировании связано с необходимостью подавления патогенной, анаэробной микрофлоры, в первую очередь Clostridium botulinum. Но нитриты добавляют в рыбные и…
Особого внимания заслуживает изучение возможности образования в организме из нитрита и диметиламина (ДМА) канцерогенного диметилнитрозамина (ДМНА), который вызывает опухоли у шестивидов лабораторных животных. В острых опытах на крысах и мышах одновременное введение в желудок больших доз предшественников приводило к образованию ДМНА, вызывавшего некрозы печени (Asahina е. а., 1971; Сагdesa e.a., 1974). Поражения органа были выражены значительно…
До последнего времени полностью отсутствовали данные о влиянии предшественников синтеза ДМНА на систему превращения этого канцерогена в печени. Исследования Е. Д. Карпиловской и Б. Л. Рубенчика (1977) показали, что пероральное введение крысам ДМА (1,5 г/кг), нитрита натрия (125 мг/кг) или комбинации этих предшественников ДМНА повышает активность деметилазы этого канцерогена в микросомах печени крыс. В условиях…
Механизмы процессов нитрозирования in vivo изучены пока недостаточно. Большинство работ связано с исследованием образования НС в желудке, однако не исключена возможность их эндогенного синтеза в других органах: ротовой полости, кишечнике, инфицированном микроорганизмами мочевом пузыре или матке. Предшественникам НС в организме, по-видимому, могут быть вторичные, третичные амины и четвертичные аммониевые соединения. Реакция нитрозирования in vitro и в…
Среди ингибиторов нитрозирования наибольшее значение имеет аскорбиновая кислота и некоторые другие соединения, действие которых будей рассмотрено в главе «Природные ингибиторы нитрозирования». Смотреть раздел — Природные ингибиторы нитрозирования. Некоторые условия и особенности кинетики нитрозирования, изученные в буферных растворах или биологических средах in vitro, несомненно существенны для понимания процессов, происходящих in vivo. В последнем случае возникает ряд…
Нитраты поступают в организм человека с водой, овощами и в качестве добавок при консервировании мяса. Среди овощей большое количество нитратов содержит шпинат, свекла, редис, баклажаны, сельдерей, салат, турнепс и др. В некоторых овощах содержание нитрата составляет 3000 мг/кг, но может значительно колебаться, что зависит от генетических особенностей растения и условий произрастания. В шпинате содержание нитратов…
Нами будет рассмотрена потенциальная возможность образования in vivo в животном организме канцерогенных НС только из тех предшественников, которые образуются в организме или (и) обнаруживаются в пищевых продуктах. За последние годы установлено, что нитрозированию могут подвергаться различные продукты метаболизма животного организма. Так, нитрозирование in vivo показано для аминокислот — аргинина, пролина и оксипролина. Не исключена возможность,…
Источник
НИТРАТЫ И НИТРИТЫ
Широко распространены в окружающей среде, главным образом в почве и воде. Наряду с нитратами в почве содержится другой минеральный источник азота — аммоний. Последний адсорбируется почвой и нитрифицируется. Ион NO3 почвой не поглощается, поэтому весь нитратный азот находится в почве в растворе, легко подвижен и доступен для растений. Нитраты быстро и легко реагируют с другими компонентами почвы.
Растения ассимилируют нитраты с помощью корневой системы двумя путями:
- восстановлением нитратов в нитриты с помощью нитрат-редуктазы НАДФ ž Н;
- восстановлением нитратов в аммиак с помощью нитрит-редуктазы.
Нитритов в растениях содержится небольшое количество, в среднем 0,2 мг/кг, поскольку они представляют собой промежуточную форму восстановления окисленных форм азота в аммиак.
Концентрация нитратов в растениях колеблется от нескольких до тысяч миллиграммов, зависит от многих факторов, среди которых определяющим является увеличение нитратов в почве за счет интенсификации процесса нитрификации или — особенно — в связи с неконтролируемым использованием азотных удобрений.
Отмечено, что некоторые пестициды, другие токсические соединения, нарушая обмен веществ в растениях, усиливают накопление нитратов, например гербицида 2,4-Д — в 10-20 раз.
В табл. 35 и 36 представлены данные Института питания РАМН о содержании нитратов и нитритов в пищевых продуктах. Из таблиц видно, что наибольшие концентрации нитратов встречаются в зелени, овощах, особенно корнеплодах, бахчевых культурах.
Необходимо отметить, что парниковая зелень отличается более высоким содержанием нитратов, что объясняется интенсивным удобрением почвы и недостаточным освещением. Содержание нитритов в пищевых продуктах может возрастать по мере их хранения. Это связано с развитием микрофлоры, способной восстанавливать нитраты. Восстанавливающими свойствами обладают многие представители лактобацилл, E. coli, Ps. fluorescens, некоторые виды стрептококков, B. subtilis, другие микроорганизмы. В этой связи детям рекомендуется употреблять сок в течение 1 ч после его приготовления.
Кулинарная обработка пищевых продуктов снижает содержание в них нитратов: очистка, мытье и вымачивание — на 5-15 %, варка — до 80 % (в связи с переходом нитритов в отвар, инактивацией ферментов, восстанавливающих нитраты в нитриты). При более жесткой тепловой обработке нитраты разрушаются с образованием оксидов азота и кислорода.
Механизм токсического действия нитритов на организм заключается в их взаимодействии с гемоглобином крови. В результате окисления двухвалентного железа до Fe (III) образуется метгемоглобин, который в отличие от гемоглобина не способен связывать и переносить кислород. Развивается клиническая картина гипоксии. 1 мг нитрита натрия может перевести в метгемоглобин около 2000 мг гемоглобина.
ДСД нитрита — 0,2 мг/кг массы тела, за исключением детей грудного возраста. Острое отравление отмечается при одноразовой дозе 200-300 мг, летальный исход — 300-2500 мг. Токсичность нитритов зависит от состава рациона, индивидуальных особенностей организма, в частности, от активности метгемоглобинредуктазы, обладающей способностью восстанавливать метгемоглобин в гемоглобин.
Наряду с клиническими проявлениями интоксикации (обильное потение, синюшность кожи, одышка, головокружение) хроническое воздействие нитритов приводит к снижению содержания в организме витаминов A, E, C, B1, B6. С этим связывают снижение устойчивости организма к воздействию различных факторов, в том числе онкогенных.
Нитраты, в отличие от нитритов, не являются метгемоглобинообразователями и не обладают выраженной токсичностью. Острые отравления наблюдаются у людей при случайном приеме 1-4 г нитратов, доза 8-14 г может оказаться смертельной. Главной причиной острой интоксикации является восстановление нитратов в нитриты, что может происходить в пищевых продуктах или пищеварительном канале.
Таблица 35
Содержание нитратов в продовольственном сырье и пищевых продуктах (в пересчете на нитрат-ион)
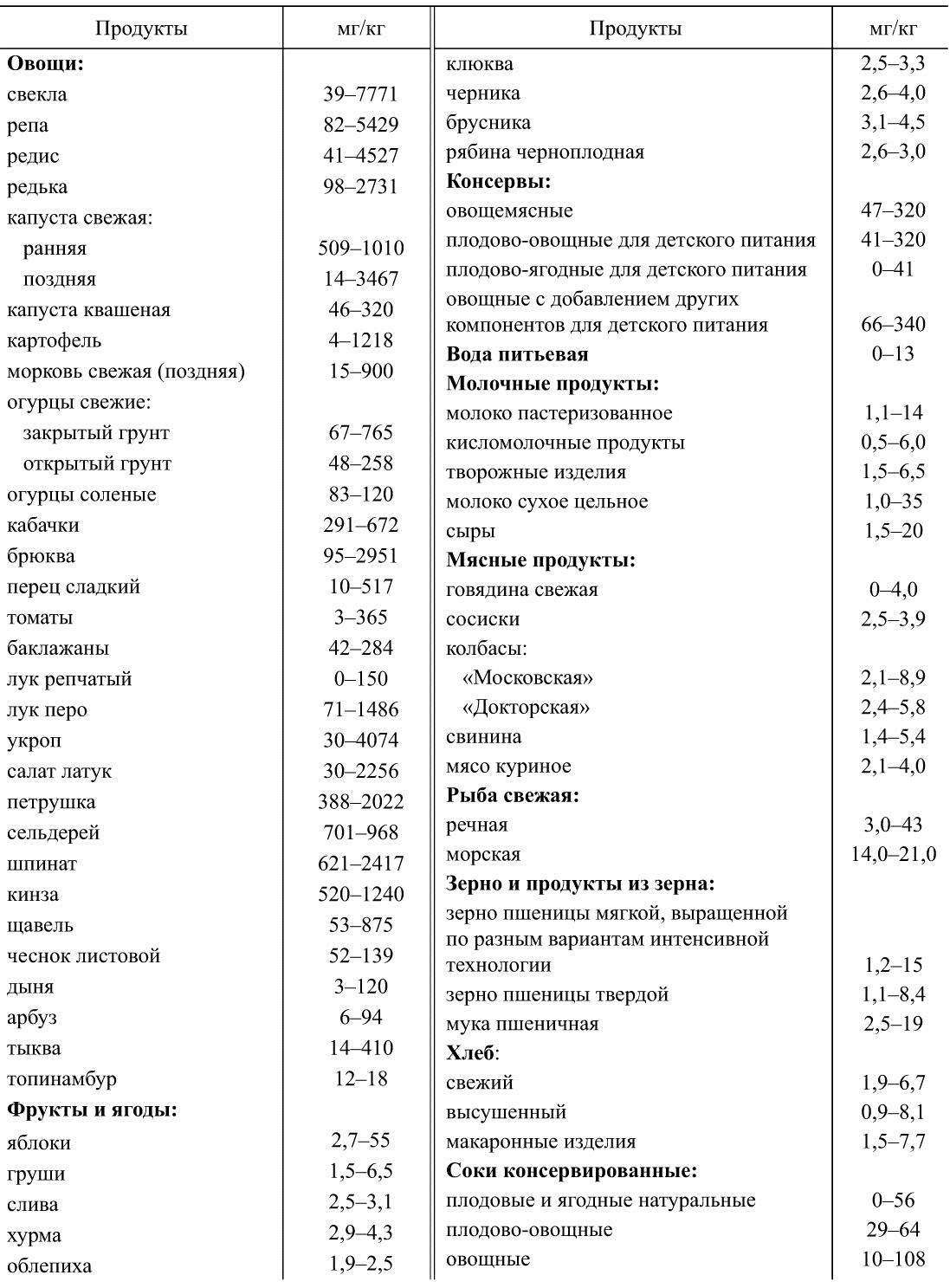
Таблица 36
Содержание нитритов в продовольственном сырье и пищевых продуктах (в пересчете на нитрит-ион)
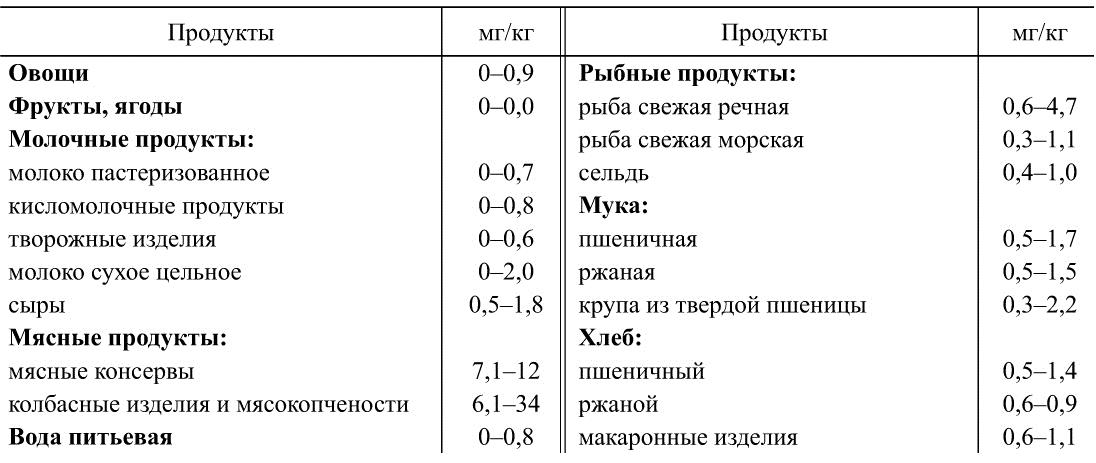
Согласно данным ФАО/ВОЗ, ДСД нитратов составляет 5 мг/кг массы тела в расчете на нитрат-ион. Мишенью действия больших доз нитратов являются ядра гепатоцитов и нуклеиновый обмен, что объясняет преимущественно эмбриотоксическое действие этих соединений.
НОРМИРОВАНИЕ НИТРАТОВ,
НИТРИТОВ КАК ПИЩЕВЫХ ДОБАВОК
Осуществляется в связи с их использованием в производстве некоторых продуктов питания. Содержание нитритов в пищевых продуктах допускается до 50 мг/кг, в солонине из говядины и баранины — до 200 мг/кг, в экспортируемых — до 30 мг/кг. Для обеспечения указанных нормативов нитриты используют в следующих количествах: засолка говядины, баранины и конины — 0,10-0,12 % от массы рассола; для свинины — 0,06-0,08 %, колбасных изделий — 0,003-0,005 % от массы мяса.
Нитрит натрия или калия используется в качестве консерванта сыра и брынзы — 300 мг на 1 л молока.
ДОПУСТИМЫЕ КОНЦЕНТРАЦИИ
В РАЦИОНЕ И ПРОДУКТАХ ПИТАНИЯ
ДСД нитратов для человека составляет 300-325 мг. ПДК в питьевой воде — 45 мг/л, или 10 мг нитратного азота в 1 л. Если учитывать потребление питьевой воды в размере 2 л в сутки, то на долю ДСП через пищевые продукты приходится 210 мг нитратов (300 — 45 ž 2 = 210).
Основным источником поступления нитратов в организм человека являются продукты растительного происхождения, в частности овощи (82-92 %) (табл. 37). Основные поставщики нитритов — мясные продукты, на долю которых приходится 53-60 % от общего поступления нитритов в организм человека.
Таблица 37
Допустимые уровни содержания нитратов в продуктах растительного происхождения
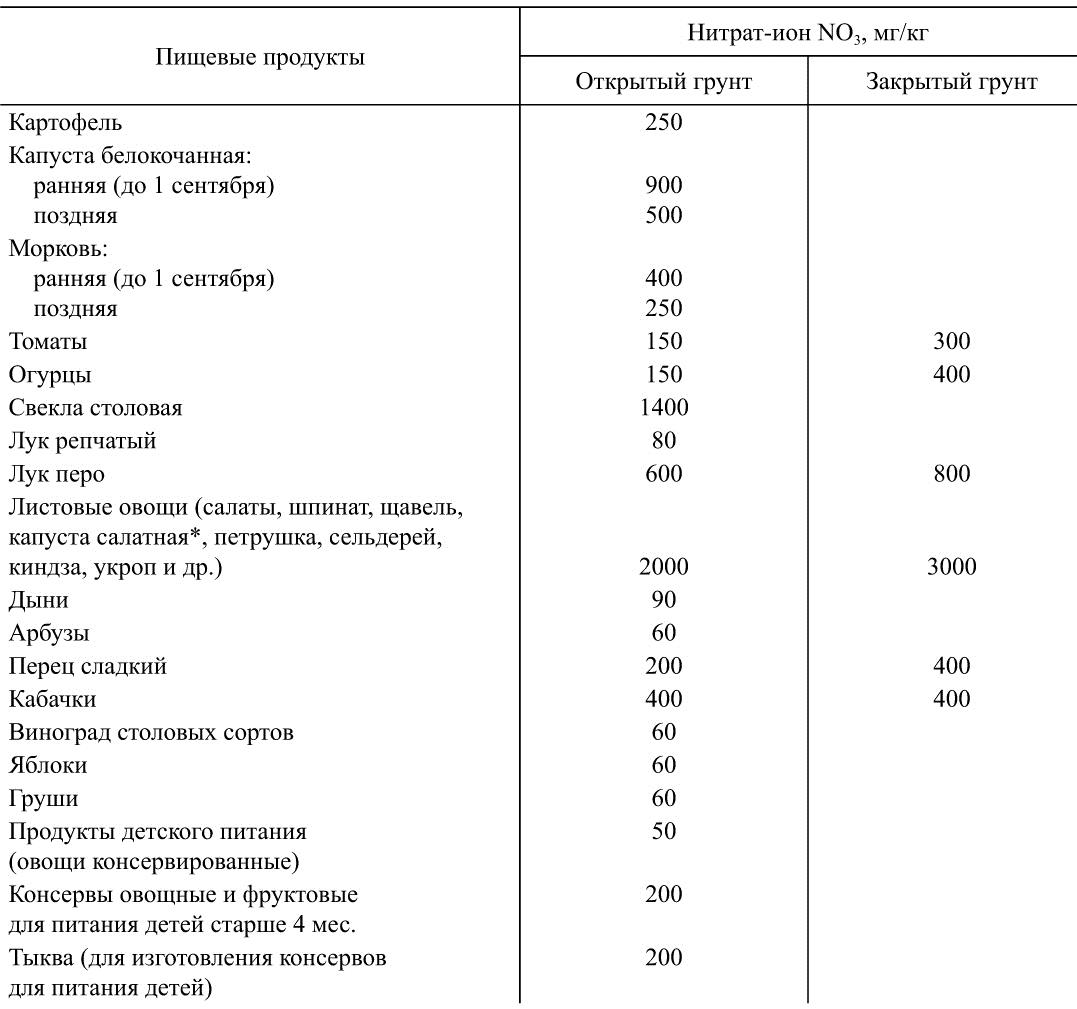
Источник: Санитарно-гигиенические нормы (№ 4619-88).
* Капуста салатных сортов, поставляемая по общероссийскому фонду до 1 июня.
Согласно рекомендациям ВОЗ, детей грудного возраста до 6 мес. не следует кормить продуктами с содержанием нитратов более 10 мг/кг, нитритов — более 0,05 мг/кг, поить питьевой водой с концентрацией нитратов более 1 мг/л, нитритов — более 0,005 мг/л.
Важное значение для снижения уровня загрязнения пищевых продуктов нитратами и нитритами имеет квалифицированная работа агрохимической и ветеринарной служб, соблюдение имеющихся правил и ведомственных документов.
НИТРОЗОСОЕДИНЕНИЯ (НС)
В настоящее время на живых организмах испытано более 300 нитрозосоединений, содержащихся в окружающей среде. Все они обладают канцерогенными, мутагенными, тератогенными и эмбриотоксическими свойствами. Канцерогенное действие этих соединений является определяющим.
Таблица 38
Максимальное содержание НДМА, НДЭА, НПиР, НПиП
в отечественных пищевых продуктах и продовольственном сырье

Источники: Рубенчик Б. Л. Питание, канцерогены и рак. Киев: Наук. думка, 1983; Жукова Г. Ф. Содержание N-нитрозоаминов в отечественных пищевых продуктах // Вопр. питания, 1988. № 6. С. 55-59.
Общей для НС является нитрозогруппа (N-N=O), к которой могут присоединяться различные радикалы: алкильный, арильный, алициклический и др., включая эфирные, ароматические амидогруппы и т. д.
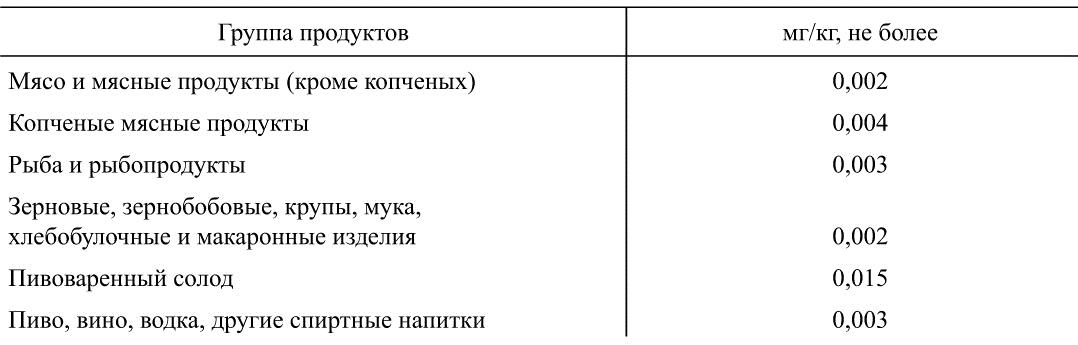
Таблица 39
Допустимые уровни содержания N-нитрозаминов в продовольственном сырье и пищевых продуктах
(суммарное содержание N-нитрозодиметиламина и N-нитрозодиэтиламина)
В общей схеме экзогенного воздействия на человека нитрозосоединений основное место отводится пищевым продуктам, что обусловлено широким применением в технологии их производства нитритов и коптильного дыма, содержащего окислы азота. Нитрит и оксиды азота обладают способностью легко нитрозировать вторичные и третичные амины пищевых продуктов с образованием нитрозосоединений.
НС могут образовываться в результате технологической обработки сельскохозяйственного сырья и полуфабрикатов, варки, жарения, соления, длительного хранения. При этом чем интенсивнее термическая обработка и длительнее хранение пищевых продуктов, тем больше вероятность образования в них НС.
В свежих продуктах НС содержатся в незначительных количествах, за исключением случаев, когда эти продукты изготовлены с нарушением технологических режимов и из сырья с высоким исходным уровнем предшественников реакций нитрозирования.
Нитраты и нитриты, содержащиеся в пищевых продуктах, являются предшественниками для эндогенного синтеза нитрозоаминов в организме человека.
Наибольшее распространение получили следующие нитрозосоединения: N-нитрозодиметиламин (НДМА), N-нитрозодиэтиламин (НДЭА), N-нитрозодипропиламин (НДПА), N-нитрозодибутиламин (НДБА), N-нитрозопиперидин (НПиП), N-нитрозопирролидин (НПиР).
Нитрозодиметиламин (НДМА) — основной канцероген, порождающий онкологические заболевания. Как и многие химические вещества в процессе синтеза, НДМА приобретает новые свойства и воздействует на человека как канцерогенный (злокачественные образования, 132 формы), эмбриотоксичный (поражение эмбриона), тератогенный (врожденные уродства) и мутагенный (нарушает генную структуру клетки, ДНК, и изменяет наследственность) фактор.
В настоящее время в США, Канаде и других развитых странах НДМА не используется в производстве или коммерции.
Содержание нитрозосоединений в отдельных группах пищевых продуктов представлено в табл. 38 (данные 1988 г.). В настоящее время картина загрязнения пищевой продукции остается практически прежней.
С суточным рационом человек получает ориентировочно 1 мкг НС, с питьевой водой — 0,01 мкг, с вдыхаемым воздухом — 0,3 мкг. В зависимости от степени загрязнения объектов окружающей среды эти цифры могут существенно колебаться. Половину всех НС человек получает с солено-копчеными продуктами. Допустимые уровни содержания НС в пищевых продуктах даны в табл. 39.
Источник
Нитрозосоединения
Нитрозосоединения (пояснения в тексте)
Нитрозосоединения — органические, содержащие одну или несколько нитрозогрупп -N=O, связанных с атомами углерода (C-нитрозосоединения), азота (N-нитрозосоединения — нитрозамины, R2N-N=O) или кислорода (O-нитрозосоединения — органические нитриты, сложные эфиры азотистой кислоты) [1], серы (нитрозотиолы, RS-N=O) [2]. Под нитрозосоединениями обычно подразумевают C-нитрозосоединения. Можно рассматривать эти соединения, как углеводородные производные нитрозила. Известны и неорганические нитрозильные соединения, как с металлами (M-N=O) так и с неметаллами (например, Cl-N=O, NO-ClO4) [2].
Свойства[править | править код]
Нитрозосоединения способны к димеризации и в растворах и расплавах существуют в виде равновесных смесей мономера и димера, в индивидуальном состоянии большинство нитрозосоединений представляют собой димеры, для которых возможна цис-транс-изомерия[3]:
При введении электроноакцепторных заместителей тенденция к димеризации уменьшается: трихлор- и трифторнитрозометаны существуют преимущественно в виде мономеров. Транс-изомеры стабильнее цис-изомеров. В растворах и при нагревании увеличивается степень диссоциации димеров.
Органические нитрозосоединения способны к координационным взаимодействиям с ионами металлов [2].
Мономерные нитрозосоединения окрашены в зелёный или голубой цвет, в спектрах мономерных нитрозосоединений наблюдаются три максимума: в видимой области при 630-790 нм (e ~ 45-60, полоса nπ-перехода), в ультрафиолетовой области — при 270-290 нм (e ~ 80, полоса σπ*-перехода) и 220 нм (e ~ 5⋅103, полоса ππ*-перехода). Димерные нитрозосоединения бесцветны в УФ-спектрах транс-изомеров полоса поглощения при 280-300 нм (e ~ 5⋅103 — 12⋅103, полоса ππ*-перехода), у цис-изомеров эта полоса сдвинута в коротковолновую область на 10-15 нм[3].
В ИК-спектрах мономерных нитрозосоединений присутствует характеристическая полоса при 1540-1620 см−1 (алифатические нитрозосоединения) или 1500-1512 см−1 (ароматические нитрозосоединения) валентных колебаний нитрозогруппы. У транс-димеров алифатических и ароматических нитрозосоединений эта полоса наблюдается при 1176-1290 и 1253-1299 см−1 соответственно, у цис-димеров эти полосы проявляются в виде дублетов при 1323-1344 см−1 и 1330-1420 см−1 (у алифатических нитрозосоединений) и 1389 см−1 и 1409 см−1 (у ароматических нитрозосоединений)[3].
В масс-спектрах (в том числе для димеров) присутствуют пики молекулярных ионов и пики характеристической фрагментации. Общей чертой является лёгкость отщепления NO[3].
Реакционная способность[править | править код]
Проявляют слабые основные свойства.
Особенностью первичных и вторичных нитрозосоединений (то есть содержащих атом водорода в α-положении к нитрозогруппе), является способность к необратимой изомеризации в оксимы[3]:
Такая изомеризация проходит in situ при нитрозирования некоторых алканов (например, циклогексана нитрозилхлоридом NOCl) или соединений с активированной метильной либо метиленовой группой и служит препаративным методом синтеза оксимов:
Повышение температуры, полярные растворители, сильные кислоты или основания, а также NO ускоряют изомеризацию (в последнем случае конкурентным процессом является димеризация с образованием алкилацилгидразинов).
Оксимы могут образовываться и в результате фрагментации некоторых третичных нитрозосоединений[3]:
Для соединений с нитрозогруппой вообще характерна таутомерия: если помимо нитрозогруппы соединение содержит ещё какие-либо группы с высоко электроотрицательным атомом, то таутомерные перегруппировки будут вести к образованию не только оксимов, но и других классов соединений. Например, п-нитрозофенол существует в равновесии с оксимом п-бензохинона (последний преобладает); о-нитрозофенол мало склонен к таутомерии; п-нитрозоанилины также существуют в равновесии со своими хиноидными изомерами.
Возможны и другие варианты внутримолекулярных взаимодействий: водородные связи, изомеризация о-динитрозобензолов в бензофуроксаны.
Реакции окисления[править | править код]
Окислители (например: озон, пероксид водорода в щелочной среде, надкислоты, кислород воздуха, азотная кислота, перманганат, оксид хрома (VI) и другие подобные по окислительной силе) легко окисляют нитрозогруппу до нитрогруппы. Алифатические нитрозосоединения окисляются несколько легче ароматических. В случае последних, окисление облегчается при наличии электронодонорных заместителей в пара-положении к нитрозогруппе.
Реакции восстановления[править | править код]
В зависимости от восстановителя, удаётся превратить нитрозосоединения в амины и, в случае более мягких восстановителей (например, спиртовые растворы щелочей, арсенит, борогидрид натрия), в гидроксиламины. Последние легко конденсируются с остающимися в смеси нитрозосоединениями до азоксисоединений. Для защиты нитрозогруппы от дальнейшего восстановления и конденсации используют ароматические сульфиновые кислоты. Для получения аминов используют более интенсивные восстановители: дитионит натрия, гидрирования с катализаторами (например, с никелем Рения или условия металл-кислота). Биснитрозоалканы могут восстанавливаться сразу в амино-, азокси- и гидразосоединения, не переходя в мономеры. При восстановлении гем-нитрозохлорсоединений гидридами металлов образуются оксимы.
Известны реакции дезоксигенирования нитрозосоединений производными трёхвалентного фосфора (до азоксисоединений, до фосфоимидатов и продуктов их гидролиза, до ряда других продуктов), изоцианидами (до карбодиимидов).
Гем-нитрозохлорциклоалканы при десоксигенировании фосфином претерпевают перегруппировку Бекмана с расширением цикла. Реакцией нитрозофенола с трифенилфосфином в бензоле (в присутствии диалкиламинов) удалось синтезировать 2-амино-3-N-азепины.
Реакции с ненасыщенными системами[править | править код]
Реакции присоединения и конденсации[править | править код]
Реакции захвата радикалов[править | править код]
Нитрозосоединения (особенно ароматические) являются хорошими ловушками для захвата свободных радикалов. Их используют для ингибирования реакций полимеризации (протекающих по радикальному механизму). В общем случае реакция с радикалами приводит к образованию полностью замещённых гидроксиламинов (например, реакция нитрозометана с метильными радикалами приводит к образованию триметилгидроксиламина).
Также ароматические нитрозосоединения реагируют с NO, давая нитраты диазония или продукты их разложения. Алифатические нитрозосоединения в подобных реакциях дают нитросоединения, нитраты и следы нитритов.
Фотохимические реакции[править | править код]
При облучении нитрозосоединений обычно образуются нитроксилы. Для алифатических нитрозосоединений обычно требуется красный свет (>680 нм), для ароматических — обычно ультрафиолетовый. Гомологи нитрозобензола начинают реагировать при облучении более длинноволновым светом, чем сам нитрозобензол. Один из побочных процессов при облучении нитрозоаренов — восстановление их до азоксисоединений. При облучении нитрозоалканов также наблюдается их димеризация, расщепление C-N и C-H связей, в присутствии кислорода — окисление.
Реакции замещения[править | править код]
В ароматических нитрозосоединениях, в силу того, что нитрозогруппа является сильным акцептором электронов (для сравнения — сильнее, чем нитрогруппа), под действием нуклеофильных реагентов достаточно легко протекают реакции обмена пара-заместителями.
Так, п-нитрозодиметиланилин гидролизуется водными растворами щелочей до оксима хинона и диметиланилина.
Электрофильное замещение также ведёт к образованию пара-продуктов (например, при бромировании или при нитровании).
Качественное и количественное определение[править | править код]
- Взаимодействие с азотистой кислотой с образованием N- нитрозаминов. Последние плохо растворимы в воде и выделяются в виде желтых кристаллов или масла.
- Реакция с фенолом или резорцином в концентрированной серной кислоте — появляется тёмно-красное окрашивание, после добавления NaOH переходящее в тёмно-голубое (реакция Либермана).
- Реакция со смесью серной кислоты и дифениламином — появляется интенсивное голубое окрашивание.
- Для количественного определения измеряют количество азота, выделяющегося в реакции с фенилгидразином
Нитрозосоединения применяют как полупродукты в синтезе аминокислот, гетероциклических соединений, некоторых других классов соединений. Они являются промежуточными продуктами при превращениях между нитро- и аминогруппами, что может быть существенно для планирования синтезов. Используются при переработке (и иногда как отвердители) эластомеров. Применяют их и как аналитические реагенты. Орто-нитрозофенолы и орто-нитрозонафтолы применяют для синтеза красителей (обычно не сами, а их анионные комплексы с d-металлами) и для синтеза лекарственных препаратов. Некоторые представители обладают канцерогенной и мутагенной активностью, могут вызывать кожные заболевания[4].
В организме нитрозосоединения (и нитроксильные радикалы) образуются как промежуточные продукты метаболизма нитритов и нитратов, вместе с аминами нитриты могут участвовать в спонтанных реакциях нитрозилирования (например, попадая из пищеварительного тракта в кровь, могут нитрозилировать гемоглобин и миоглобин). Показано, что такие реакции протекают интенсивнее в условиях высокой закисленности (например, в желудке), высокой концентрации аминов (например, белковая диета), низкой концентрации витамина С (реагирует с нитритами, превращая их NO)[2].
Методы получения[править | править код]
Из более восстановленных соединений[править | править код]
- Окисление аминов и гидроксиламинов
Обычно в качестве окислителей используют пероксикислоты (Например, монопироксисерную кислоту).
В случае окисления первичных ароматических аминов выходы составляют порядка 65%. Реакция идёт и с первичными алифатическими аминами (аминогруппа при третичном углеродном атоме), но с на порядок меньшими выходами. Алифатические амины, в которых аминогруппа связана с первичным или вторичным углеродным атомом в основном превращаются в первичные либо вторичные биснитрозосоединения, либо в оксимы [3][5].
С высокими выходами алифатические биснитрозосоединения получают в реакциях:
- Окисление пероксикислотами нитронов и азометинов
- Окисление N-замещённых гидроксиламинов различными окислителями. Для алифатических соединений подходят: водные растворы галогенов, Оксид ртути(II), хромовая кислота, йодная кислота, карбонат серебра в дихлорметане. Для ароматических производных применяют: перманганат в кислой среде, хлорид железа(III), тетраацетат свинца. Для особенно чувствительных к окислению соединений подходят диэтиловый эфир азодикарбоновой кислоты.
Вообще, некоторые алкилгидроксиламины склонны самопроизвольно диспропорционировать на амин и нитрозосоединение. Способ хорошо подходит для получения третичных нитрозосоединений [3].
Из более окисленных соединений[править | править код]
- Восстановление нитросоединений возможно, но неудобно использовать как метод получения нитрозосоединений — так как обычно трудно остановить восстановление на нужной стадии. Можно получить гем-нитрозохлорсоединения обработкой солей нитросоединений эфирным раствором хлороводорода:
Для аккуратного восстановления нитросоединений необходимо использовать слабые восстановители, в нейтральных растворах. Например, применяют гидроксиламин, сульфид натрия, оксид олова(II) в метанольных растворах щелочей [3].
Реакции нитрозирования[править | править код]
- Реакции нитрозирования подобны реакциям нитрования. Ароматические соединения, содержащие при бензольном кольце электронодонорные заместители (OH, NR2, NHR) при взаимодействии с водными разбавленной азотистой кислотой (можно использовать в качестве источника азотистой кислоты подкисленные растворы нитритов щелочных металлов), переходят в нитрозосоединения (нитрозогруппа замещает атом водорода преимущественно в пара-положении к имевшемуся заместителю). Нитрозирующими агентами могут быть катион нитрозония NO+, оксиды N2O3 и N2O4, молекулы азотистой кислоты.
Реакции ведут при низких (порядка 273 K) температурах (при повышении температуры уменьшается выход продукта)[6].
- O-Нитрозосоединения могут быть получены в реакции этерификации спиртов с азотистой кислотой:
- S-нитрозосоединения могут быть получены тем же путём (эти реакции протекают интенсивнее, чем в случае спиртов, так как атом серы является более нуклеофильным):
Соединения стабильны в кислых растворах.
- Пример реакции получения нитрозаминов за счёт генерации иона нитрозония NO+ из нитрит-иона NO2-:
Таким образом, например, при консервировании мяса могут образовываться (в том числе и канцерогенные) нитрозосоединения из аминов (нитриты часто используются как консерванты и фиксаторы окраски).
Первичные нитрозамины подвержены гидролизу до спиртов, более устойчивы вторичные и ароматические нитрозамины[2].
Прочие реакции[править | править код]
- Синтезы из алкилнитрилов
- Свободнорадикальные процессы
- Присоединение к алкенам
- Галогенирование оксимов
- Фотохимические реакции алканов (в газовой фазе) с оксидом азота (II) в присутствии каталитических количеств хлора приводит к образованию биснитрозоалканов:
При увеличении доли хлора в смеси получаются гем-нитрозохлорсоединения, которые могут быть далее восстановительно дегалогенированы до оксимов:
При облучении смеси алкана и с хлороводородом в присутствии NO также получаются оксимы. В условиях избытка (3:1) NO получают биснитрозосоединения.
Получение методами фотолиза обычно ведёт к смеси изомеров [3].
Литература[править | править код]
- Бартон Д, Оллис Д.(ред.) «Общая органическая химия» в 12 т., М.:Химия, 1982. Т.3 «Азотсодержащие соединения»
- Биляев Е.У, Гидаспов Е. В. «Ароматические нитрозосоединения» С-Пб.:Теза, 1996. — 208 с.
- Губен И. «Методы органической химии» том 4, книга 1. М.:ГХИ, 1949. — С.: 98-191
- Фойер Г. (ред.) «Химия нитро- и нитрозосоединений» в 2 т., М.:Мир, 1972.
- Кнунянц И. Л. (глав.ред.) «Химическая энциклопедия» в пяти томах. М.:Советская энциклопедия, 1988. Т.3
- Lijinsky W. «Chemistry and biology of N-nitroso compaunds». 1992. N.Y.
- Patai S., Rappoport Z. «Amino, Nitroso, Nitro and Groups» («The Chemistry of al Groups»). 1996. John Wiley & Sons Ltd. — 1423 p.
Примечания[править | править код]
- ↑ nitroso compounds // IUPAC Gold Book
- ↑ 1 2 3 4 5 перевод англоязычной версии статьи
- ↑ 1 2 3 4 5 6 7 8 9 10 Бартон Д, Оллис Д.(ред.) «Общая органическая химия» в 12 т., М.:Химия, 1982. Т.3, стр. 372-399
- ↑ Кнунянц И. Л. (глав.ред.) «Химическая энциклопедия» в пяти томах. М.:Советская энциклопедия, 1988. Т.3, С.: 271-275
- ↑ Губен И. «Методы органической химии» том 4, книга 1. М.:ГХИ, 1949. — С.: 98-191
- ↑ Лисицын В. Н. «Химия и технология промежуточных продуктов» — М.:Химия, 1987. — 368 с. — С.: 134-138
Источник