При каком давлении воздух растворяется в воде
Содержание статьи
Растворимость воздуха в воде. Деаэрация. Закон Генри. Коэффициенты Генри для воздуха.
Растворимость воздуха в воде. Деаэрация. Закон Генри. Коэффициенты Генри для воздуха.
Количество воздуха, способного к растворению в воде — снижается при повышении температуры и повышается при повышении давления.
Деаэрация.
При нагревании пресной воды начинают формироваться воздушные пузырьки. Как известно, вода не может удерживать растворенный воздух при повышении температуры. При 1 баре и температуре 100 0C (2120F) вода закипает и тогда уже водяной пар формирует пузырьки. Если быстро охладить воду, а потом снова ее нагреть, пузырьки не появятся до тех пор пока вода не закипит. Вода деаэрирована.
Растворимость.
Растворимость воздуха может быть выражена через соотношение:
Sa = ma/ mw
где
Sa = массовая доля растворимого воздуха в воде
ma = масса воздуха (кг)
mw = масса воды (кг)
Закон Генри.
Процесс растворения воздуха в воде подчиняется закону Генри, который гласит: «При постоянной температуре растворимость газа в данной жидкости прямо пропорциональна давлению этого газа над раствором (равна давлению в растворе).» — В символьном виде закон может быть записан как:
c = k H pg
где
c = концентрация газа в растворе
k H = коэффициент Генри
pg = парциальное давление газа над раствором
Растворимость кислорода в воде выше растворимости азота. Воздух, растворенный в воде содержит приблизительно 35,6 % кислорода по сравнению с 21% долей в обычном воздухе.
Пример — Расчет количества воздуха, растворенного в воде.
Количество воздуха, растворенного в воде может быть посчитано, исходя из закона Генри.
Коэффициенты Генри при температуре окружающей среды 25oC (77oF)
* Кислород — O2 : 756.7 атм/(моль/л)
* Азот — N2 : 1600 атм/(моль/л)
Молярные веса
* Кислород — O2 : 31.9988 г/моль
* Азот — N2 : 28.0134 г/моль
Относительное содержание (по объему) в воздухе:
* Кислород — O2 : ~ 0.21
* Азот — N2 : ~ 0.79
Объем кислорода, растворенного в воде при атмосферном давлении может быть посчитан как :
co = (1 атм) 0.21 / (756.7 атм/(моль/л)) (31.9988 г/моль)
= 0.0089 г/л
~ 0.0089 г/кг
Объем азота, растворенного в воде при атмосферном давлении может быть посчитан как:
cn = (1 атм) 0.79 / (1600 атм/(моль/л)) (28.0134 г/моль)
= 0.0138 г/л
~ 0.0138 г/кг
Поскольку воздух-это сумма кислорода и азота :
ca = (0.0089 г/л) + (0.0138 г/л)
= 0.0227 г/л
~ 0.023 г/кг
Таблица. Количество (масса) воздуха, растворенного в воде при различных давлениях и температуре 25oC (77oF):
Абсолютное давление (атм) | 1 | 2 | 3 | 4 | 5 | 6 |
| Объем растворенного в воде воздуха при 250C (г/кг) | 0,023 | 0,045 | 0,068 | 0,091 | 0,114 | 0,136 |
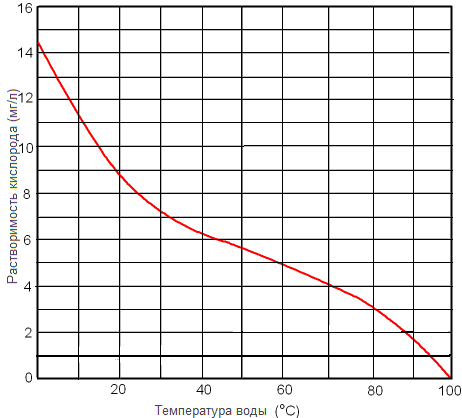
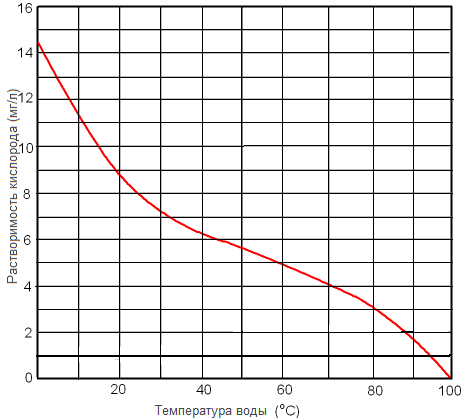
Рисунок. Растворимость кислорода в пресной воде при 1 атм в зависимости от температуры.
Деаэрация
Для максимальной деаэрации вода должна быть нагрета до 2120F (1000C) при атмосферном давлении. Это обычное инженерное решение для паровых систем, где пресная вода подается в систему через нагретый деаэратор наверху конденсатоприемника.
Также обычным решением является установка деаэрационных устройств с горячей стороны теплообменника в отопительных системах для интенсификации удаления растворенного воздуха из системы.
Поскольку максимум деаэрации приходится на минимум статического давления и максимум температуры в системе, то наилучший результат деаэрации достигается в верхних точках систем относительно уровня земли и/или на входе насоса.
Источник
Растворимость воздуха в воде. Деаэрация. Закон Генри. Коэффициенты Генри для воздуха. — Инженерный справочник DPVA.ru / Технический справочник ДПВА
Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Рабочие среды / / Воздух. Атмосфера (хладагент R729) / / Растворимость воздуха в воде. Деаэрация. Закон Генри. Коэффициенты Генри для воздуха.
Количество воздуха, способного к растворению в воде — снижается при повышении температуры и повышается при повышении давления. Деаэрация.При нагревании пресной воды начинают формироваться воздушные пузырьки. Как известно, способность воды удерживать растворенный воздух падает при повышении температуры. При 1 баре и температуре 100 0C (2120F) вода закипает, при этом содержание растворенного воздуха падает практически до нуля, и тогда уже водяной пар формирует пузырьки. Если быстро охладить воду, а потом снова ее нагреть, пузырьки не появятся до тех пор пока вода не закипит, потому что вода деаэрирована. (Существует, кроме того, масса практических методик деаэрации воды, не связанных с нагреванием. В целом — деаэрация — это удаление растворенного воздуха из жидкости.) Растворимость.
Закон Генри.
Пример — Расчет количества воздуха, растворенного в воде.
Таблица. Количество (масса) воздуха, растворенного в воде при различных давлениях и температуре 25oC (77oF):
Рисунок. Растворимость кислорода в пресной воде мг/л при 1 атм в зависимости от температуры.
Деаэрация — основные принципы и правила установки деаэраторов.
| ||||||||||||||
Поиск в инженерном справочнике DPVA. Введите свой запрос: | ||||||||||||||
Поиск в инженерном справочнике DPVA. Введите свой запрос:
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста.
Вложите в письмо ссылку на страницу с ошибкой, пожалуйста.
Коды баннеров проекта DPVA.ru
Начинка: KJR Publisiers
Консультации и техническая
поддержка сайта: Zavarka Team
Free xml sitemap generator
Источник
Кислород в воде
Кислород вместе с другими газами, входящими в состав воздуха, легко растворяется в воде.
Сколько же воздуха может раствориться в воде? Говорить о растворимости воздуха в целом нельзя, нужно говорить о растворимости каждой составной части воздуха в отдельности.
Кислород, азот, аргон, двуокись углерода и другие газы обладают различной растворимостью. При одинаковых температуре и давлении чистого кислорода в воде растворится почти в 2 раза больше, чем азота, а углекислого газа — в 35 раз больше, чем кислорода.
Однако существуют общие закономерности для всех газов. Чем выше температура жидкости, тем меньше растворимость газов. В литре чистой воды при нормальном атмосферном давлении, равном 760 миллиметрам ртутного столба, и при температуре 0° растворяется около 50 кубических сантиметров чистого кислорода. А при температуре 30° — примерно в 2 раза меньше. Чистого азота при температуре 0° и нормальном атмосферном давлении растворится 24 кубических сантиметра, а при температуре 30° — 14 кубических сантиметров.
Чем выше давление газа над жидкостью, тем больше его растворимость.
Если в закрытом сосуде, наполненном на одну треть водой, создать давление в 2 атмосферы, то газа растворится вдвое больше, чем при 1 атмосфере. И, наоборот: при пониженном давлении газа растворится во столько же раз меньше, во сколько ниже давление.
Два равных объема различных газов, смешанных при давлении в 1 атмосферу, растворяясь в воде, будут вести себя как два самостоятельно существующих газа, находящихся под давлением в 1/2 атмосферы. Растворимость каждого из них будет в 2 раза меньше их растворимости при нормальном атмосферном давлении.
Воздух — это смесь газов. Так как в воздухе содержится 21 процент кислорода, то его парциальное давление, то есть та часть давления, которая падает только на кислород, будет в 5 раз меньше давления воздуха. Поэтому кислорода воздуха при нормальном атмосферном давлении растворится в воде в 5 раз меньше, чем чистого кислорода при том же давлении.
В самом деле, если при нормальном давлении и при температуре 0° насытить воду не чистым кислородом, а воздухом, то в литре воды растворится только 10 кубических сантиметров кислорода вместо 50, а азота из воздуха растворится 19 кубических сантиметров вместо 24.
В воде, содержащей различные соли, растворимость газов снижается. В речной воде кислорода растворяется меньше, чем в чистой (дистиллированной), а в морской меньше, чем в речной.
Чтобы растворить газ в воде, его нужно привести в соприкосновение или перемешать с водой; чтобы вытеснить газ из воды, воду нужно подогреть. Доведя температуру воды до 100°, можно почти полностью вытеснить из нее газ.
Вытеснение воздуха из воды кипячением: 1 — колба с водой; 2 — загнутая стеклянная трубка; 3 — стакан с водой; 4 — пробирка, в которую собирается вытесненный воздух
Возьмите колбу, наполненную доверху водой, закройте ее пробкой, в которую вставлена загнутая стеклянная трубка. Второй конец этой трубки вставьте в стакан с водой и наденьте на этот конец трубки наполненную водой пробирку. Доведите воду в колбе до кипения. В опрокинутой пробирке появится газ, тот самый газ, который был растворен в воде до ее кипячения.
Хотя до кипячения вода соприкасалась только с воздухом, но в силу различной растворимости кислорода и азота состав вытесненного газа будет существенно отличаться от состава обычного воздуха. В него входит 1 объем кислорода и 2 объема азота. А это означает, что в полученном газе кислорода уже не 21, как в воздухе, а 33 процента.
В обыкновенной, неочищенной воде, кроме растворенного газообразного кислорода, имеется еще кислород, входящий в состав растворенных в ней солей. Этот кислород вытеснить кипячением нельзя, так как он прочно связан с каким-нибудь другим элементом.
Чтобы освободить воду от солей, ее нужно перегнать.
Прибор для перегонки состоит из колбы для кипячения воды, холодильника, где конденсируются пары, и приемника, куда стекает дистиллированная вода.
Полученная таким образом вода содержит только растворенные газы, которые можно вытеснить кипячением.
Что же содержится в воде, в которой нет ни солей, ни растворенных газов?
Вода, как и всякое химическое соединение, состоит из однородных молекул.
В состав молекулы воды (Н2O) входит 2 атома водорода и 1 атом кислорода, тесно связанные между собой.
Лабораторная установка для получения дистиллированной воды: 1 — колба для кипячения воды; 2 — холодильник; 3 — приемник
Разделить, разорвать молекулу воды на ее составные части нелегко, на это нужно затратить энергию.
Молекулярный вес воды равен 18. Он состоит из 2 атомных весов водорода, равных 2 единицам, и атомного веса кислорода — 16. Следовательно, в молекуле воды содержится около 89 процентов кислорода и около 11 процентов водорода. В килограмме воды насчитывается 890 граммов кислорода.
Это означает, что все реки, моря и океаны состоят главным образом из кислорода.
Вода занимает три четверти земной поверхности.
Но в природе вода встречается не только в жидком виде. В полярных странах и на высоких горах круглый год сохраняются огромные толщи льда и снега. Большие количества воды мы встречаем в воздухе в виде пара.
Животные и растения больше чем наполовину состоят из воды. В человеческом организме, при среднем весе тела 65—70 килограммов, содержится до 40 килограммов воды.
Источник: В. Медведовский. Кислород. Государственное Издательство Детской литературы Министерства Просвещения РСФСР. Ленинград. Москва. 1953
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Источник
При каком давлении воздух растворяется в воде
Кислород в воде
Кислород вместе с другими газами, входящими в состав воздуха, легко растворяется в воде.
Сколько же воздуха может раствориться в воде? Говорить о растворимости воздуха в целом нельзя, нужно говорить о растворимости каждой составной части воздуха в отдельности.
Кислород, азот, аргон, двуокись углерода и другие газы обладают различной растворимостью. При одинаковых температуре и давлении чистого кислорода в воде растворится почти в 2 раза больше, чем азота, а углекислого газа — в 35 раз больше, чем кислорода.
Однако существуют общие закономерности для всех газов. Чем выше температура жидкости, тем меньше растворимость газов. В литре чистой воды при нормальном атмосферном давлении, равном 760 миллиметрам ртутного столба, и при температуре 0° растворяется около 50 кубических сантиметров чистого кислорода. А при температуре 30° — примерно в 2 раза меньше. Чистого азота при температуре 0° и нормальном атмосферном давлении растворится 24 кубических сантиметра, а при температуре 30° — 14 кубических сантиметров.
Чем выше давление газа над жидкостью, тем больше его растворимость.
Если в закрытом сосуде, наполненном на одну треть водой, создать давление в 2 атмосферы, то газа растворится вдвое больше, чем при 1 атмосфере. И, наоборот: при пониженном давлении газа растворится во столько же раз меньше, во сколько ниже давление.
Два равных объема различных газов, смешанных при давлении в 1 атмосферу, растворяясь в воде, будут вести себя как два самостоятельно существующих газа, находящихся под давлением в 1/2 атмосферы. Растворимость каждого из них будет в 2 раза меньше их растворимости при нормальном атмосферном давлении.
Воздух — это смесь газов. Так как в воздухе содержится 21 процент кислорода, то его парциальное давление, то есть та часть давления, которая падает только на кислород, будет в 5 раз меньше давления воздуха. Поэтому кислорода воздуха при нормальном атмосферном давлении растворится в воде в 5 раз меньше, чем чистого кислорода при том же давлении.
В самом деле, если при нормальном давлении и при температуре 0° насытить воду не чистым кислородом, а воздухом, то в литре воды растворится только 10 кубических сантиметров кислорода вместо 50, а азота из воздуха растворится 19 кубических сантиметров вместо 24.
В воде, содержащей различные соли, растворимость газов снижается. В речной воде кислорода растворяется меньше, чем в чистой (дистиллированной), а в морской меньше, чем в речной.
Чтобы растворить газ в воде, его нужно привести в соприкосновение или перемешать с водой; чтобы вытеснить газ из воды, воду нужно подогреть. Доведя температуру воды до 100°, можно почти полностью вытеснить из нее газ.
Вытеснение воздуха из воды кипячением: 1 — колба с водой; 2 — загнутая стеклянная трубка; 3 — стакан с водой; 4 — пробирка, в которую собирается вытесненный воздух
Возьмите колбу, наполненную доверху водой, закройте ее пробкой, в которую вставлена загнутая стеклянная трубка. Второй конец этой трубки вставьте в стакан с водой и наденьте на этот конец трубки наполненную водой пробирку. Доведите воду в колбе до кипения. В опрокинутой пробирке появится газ, тот самый газ, который был растворен в воде до ее кипячения.
Хотя до кипячения вода соприкасалась только с воздухом, но в силу различной растворимости кислорода и азота состав вытесненного газа будет существенно отличаться от состава обычного воздуха. В него входит 1 объем кислорода и 2 объема азота. А это означает, что в полученном газе кислорода уже не 21, как в воздухе, а 33 процента.
В обыкновенной, неочищенной воде, кроме растворенного газообразного кислорода, имеется еще кислород, входящий в состав растворенных в ней солей. Этот кислород вытеснить кипячением нельзя, так как он прочно связан с каким-нибудь другим элементом.
Чтобы освободить воду от солей, ее нужно перегнать.
Прибор для перегонки состоит из колбы для кипячения воды, холодильника, где конденсируются пары, и приемника, куда стекает дистиллированная вода.
Полученная таким образом вода содержит только растворенные газы, которые можно вытеснить кипячением.
Что же содержится в воде, в которой нет ни солей, ни растворенных газов?
Вода, как и всякое химическое соединение, состоит из однородных молекул.
В состав молекулы воды (Н2O) входит 2 атома водорода и 1 атом кислорода, тесно связанные между собой.
Лабораторная установка для получения дистиллированной воды: 1 — колба для кипячения воды; 2 — холодильник; 3 — приемник
Разделить, разорвать молекулу воды на ее составные части нелегко, на это нужно затратить энергию.
Молекулярный вес воды равен 18. Он состоит из 2 атомных весов водорода, равных 2 единицам, и атомного веса кислорода — 16. Следовательно, в молекуле воды содержится около 89 процентов кислорода и около 11 процентов водорода. В килограмме воды насчитывается 890 граммов кислорода.
Это означает, что все реки, моря и океаны состоят главным образом из кислорода.
Вода занимает три четверти земной поверхности.
Но в природе вода встречается не только в жидком виде. В полярных странах и на высоких горах круглый год сохраняются огромные толщи льда и снега. Большие количества воды мы встречаем в воздухе в виде пара.
Животные и растения больше чем наполовину состоят из воды. В человеческом организме, при среднем весе тела 65—70 килограммов, содержится до 40 килограммов воды.
Источник: В. Медведовский. Кислород. Государственное Издательство Детской литературы Министерства Просвещения РСФСР. Ленинград. Москва. 1953
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Источник
Растворимость воздуха в воде. Деаэрация. Закон Генри. Коэффициенты Генри для воздуха.
Растворимость воздуха в воде. Деаэрация. Закон Генри. Коэффициенты Генри для воздуха.
Количество воздуха, способного к растворению в воде — снижается при повышении температуры и повышается при повышении давления.
Деаэрация.
При нагревании пресной воды начинают формироваться воздушные пузырьки. Как известно, способность воды удерживать растворенный воздух падает при повышении температуры. При 1 баре и температуре 100 0 C (212 0 F) вода закипает, при этом содержание растворенного воздуха падает практически до нуля, и тогда уже водяной пар формирует пузырьки. Если быстро охладить воду, а потом снова ее нагреть, пузырьки не появятся до тех пор пока вода не закипит, потому что вода деаэрирована. (Существует, кроме того, масса практических методик деаэрации воды, не связанных с нагреванием. В целом — деаэрация — это удаление растворенного воздуха из жидкости.)
Растворимость.
- Растворимость воздуха может быть выражена через соотношение:
- Sa = ma/ mw
- где
- Sa = массовая доля растворимого воздуха в воде
- ma = масса воздуха (кг)
- mw = масса воды (кг)
- Sa = ma/ mw
Закон Генри.
- Процесс растворения воздуха в воде подчиняется закону Генри, который гласит: «При постоянной температуре растворимость газа в данной жидкости прямо пропорциональна давлению этого газа над раствором (равна давлению в растворе).» — В символьном виде закон может быть записан как:
- c = k H pg
- где
- c = концентрация газа в растворе
- k H = коэффициент Генри
- pg = парциальное давление газа над раствором
- c = k H pg
- Растворимость кислорода в воде выше растворимости азота. Воздух, растворенный в воде содержит приблизительно 35,6 % кислорода по сравнению с 21% долей в обычном воздухе.
Пример — Расчет количества воздуха, растворенного в воде.
- Количество воздуха, растворенного в воде может быть посчитано, исходя из закона Генри.
- Коэффициенты Генри при температуре окружающей среды 25 o C (77 o F)
- Кислород — O2 : 756.7 атм/(моль/л)
- Азот — N2 : 1600 атм/(моль/л)
- Молярные веса
- Кислород — O2 : 31.9988 г/моль
- Азот — N2 : 28.0134 г/моль
- Относительное содержание (по объему) в воздухе:
- Кислород — O2 :
0.79
Объем кислорода, растворенного в воде при атмосферном давлении может быть посчитан как :
- co = (1 атм) 0.21 / (756.7 атм/(моль/л)) (31.9988 г/моль) = 0.0089 г/л
0.0089 г/кг
Объем азота, растворенного в воде при атмосферном давлении может быть посчитан как:
- cn = (1 атм) 0.79 / (1600 атм/(моль/л)) (28.0134 г/моль) = 0.0138 г/л
0.0138 г/кг
Поскольку воздух-это сумма кислорода и азота :
- ca = (0.0089 г/л) + (0.0138 г/л) = 0.0227 г/л
Источник
Растворимость воздуха в воде. Деаэрация. Закон Генри. Коэффициенты Генри для воздуха.
Растворимость воздуха в воде. Деаэрация. Закон Генри. Коэффициенты Генри для воздуха.
Количество воздуха, способного к растворению в воде — снижается при повышении температуры и повышается при повышении давления.
Деаэрация.
При нагревании пресной воды начинают формироваться воздушные пузырьки. Как известно, вода не может удерживать растворенный воздух при повышении температуры. При 1 баре и температуре 100 0 C (212 0 F) вода закипает и тогда уже водяной пар формирует пузырьки. Если быстро охладить воду, а потом снова ее нагреть, пузырьки не появятся до тех пор пока вода не закипит. Вода деаэрирована.
Растворимость.
Растворимость воздуха может быть выражена через соотношение:
Sa = массовая доля растворимого воздуха в воде
ma = масса воздуха (кг)
Закон Генри.
Процесс растворения воздуха в воде подчиняется закону Генри, который гласит: «При постоянной температуре растворимость газа в данной жидкости прямо пропорциональна давлению этого газа над раствором (равна давлению в растворе).» — В символьном виде закон может быть записан как:
c = концентрация газа в растворе
k H = коэффициент Генри
pg = парциальное давление газа над раствором
Растворимость кислорода в воде выше растворимости азота. Воздух, растворенный в воде содержит приблизительно 35,6 % кислорода по сравнению с 21% долей в обычном воздухе.
Пример — Расчет количества воздуха, растворенного в воде.
Количество воздуха, растворенного в воде может быть посчитано, исходя из закона Генри.
Коэффициенты Генри при температуре окружающей среды 25 o C (77 o F)
* Кислород — O2 : 756.7 атм/(моль/л)
* Азот — N2 : 1600 атм/(моль/л)
* Кислород — O2 : 31.9988 г/моль
* Азот — N2 : 28.0134 г/моль
Относительное содержание (по объему) в воздухе:
Объем кислорода, растворенного в воде при атмосферном давлении может быть посчитан как :
co = (1 атм) 0.21 / (756.7 атм/(моль/л)) (31.9988 г/моль)
Объем азота, растворенного в воде при атмосферном давлении может быть посчитан как:
cn = (1 атм) 0.79 / (1600 атм/(моль/л)) (28.0134 г/моль)
Поскольку воздух-это сумма кислорода и азота :
ca = (0.0089 г/л) + (0.0138 г/л)
Таблица. Количество (масса) воздуха, растворенного в воде при различных давлениях и температуре 25 o C (77 o F):
Объем растворенного в воде воздуха при 25 0 C (г/кг) 0,023 0,045 0,068 0,091 0,114 0,136 - Кислород — O2 :
Рисунок. Растворимость кислорода в пресной воде при 1 атм в зависимости от температуры.
Для максимальной деаэрации вода должна быть нагрета до 212 0 F (100 0 C) при атмосферном давлении. Это обычное инженерное решение для паровых систем, где пресная вода подается в систему через нагретый деаэратор наверху конденсатоприемника.
Также обычным решением является установка деаэрационных устройств с горячей стороны теплообменника в отопительных системах для интенсификации удаления растворенного воздуха из системы.
Поскольку максимум деаэрации приходится на минимум статического давления и максимум температуры в системе, то наилучший результат деаэрации достигается в верхних точках систем относительно уровня земли и/или на входе насоса.
Источник