По какой формуле вычисляется давление газа
Содержание статьи
Давление газа — формула. Формула давления газа в сосуде
Давление является одним из трех основных термодинамических макроскопических параметров любой газовой системы. В данной статье рассмотрим формулы давления газа в приближении идеального газа и в рамках молекулярно-кинетической теории.
Идеальные газы
Каждый школьник знает, что газ является одним из четырех (включая плазму) агрегатных состояний материи, в котором частицы не имеют определенных положений и движутся хаотичным образом во всех направлениях с одинаковой вероятностью. Исходя из такого строения, газы не сохраняют ни объем, ни форму при малейшем внешнем силовом воздействии на них.
В любом газе средняя кинетическая энергия его частиц (атомов, молекул) больше, чем энергия межмолекулярного взаимодействия между ними. Кроме того, расстояния между частицами намного превышают их собственные размеры. Если молекулярными взаимодействиями и размерами частиц можно пренебречь, тогда такой газ называется идеальным.
В идеальном газе существует лишь единственный вид взаимодействия — упругие столкновения. Поскольку размер частиц пренебрежимо мал в сравнении с расстояниями между ними, то вероятность столкновений частица-частица будет низкой. Поэтому в идеальной газовой системе существуют только столкновения частиц со стенками сосуда.
Все реальные газы с хорошей точностью можно считать идеальными, если температура в них выше комнатной, и давление не сильно превышает атмосферное.
Причина возникновения давления в газах
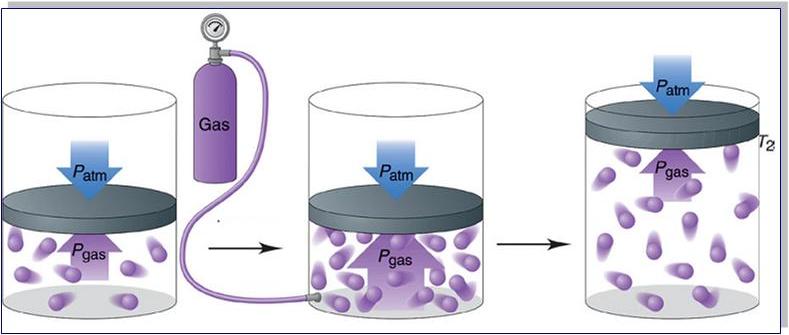
Прежде чем записать формулы расчета давления газа, необходимо разобраться, почему оно возникает в изучаемой системе.
Согласно физическому определению, давление – это величина, равная отношению силы, которая перпендикулярно воздействует на некоторую площадку, к площади этой площадки, то есть:
P = F/S
Выше мы отмечали, что существует только один единственный тип взаимодействия в идеальной газовой системе – это абсолютно упругие столкновения. В результате них частицы передают количество движения Δp стенкам сосуда в течение времени соударения Δt. Для этого случая применим второй закон Ньютона:
F*Δt = Δp
Именно сила F приводит к появлению давления на стенки сосуда. Сама величина F от столкновения одной частицы является незначительной, однако количество частиц огромно (≈ 1023), поэтому они в совокупности создают существенный эффект, который проявляется в виде наличия давления в сосуде.
Формула давления газа идеального из молекулярно-кинетической теории
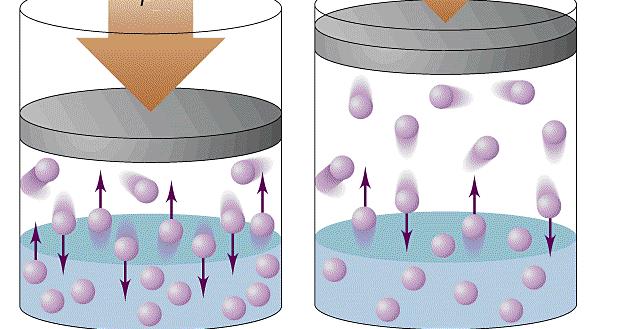
При объяснении концепции идеального газа выше были озвучены основные положения молекулярно-кинетической теории (МКТ). Эта теория основывается на статистической механике. Развита она была во второй половине XIX века такими учеными, как Джеймс Максвелл и Людвиг Больцман, хотя ее основы заложил еще Бернулли в первой половине XVIII века.
Согласно статистике Максвелла-Больцмана, все частицы системы движутся с различными скоростями. При этом существует малая доля частиц, скорость которых практически равна нулю, и такая же доля частиц, имеющих огромные скорости. Если вычислить среднюю квадратичную скорость, то она примет некоторую величину, которая в течение времени остается постоянной. Средняя квадратичная скорость частиц однозначно определяет температуру газа.
Применяя приближения МКТ (невзаимодействующие безразмерные и хаотично перемещающиеся частицы), можно получить следующую формулу давления газа в сосуде:
P = N*m*v2/(3*V)
Здесь N – количество частиц в системе, V – объем, v – средняя квадратичная скорость, m – масса одной частицы. Если все указанные величины определены, то, подставив их в единицах СИ в данное равенство, можно рассчитать давление газа в сосуде.
Формула давления из уравнения состояния

В середине 30-х годов XIX века французский инженер Эмиль Клапейрон, обобщая накопленный до него экспериментальный опыт по изучению поведения газов во время разных изопроцессов, получил уравнение, которое в настоящее время называется универсальным уравнением состояния идеального газа. Соответствующая формула имеет вид:
P*V = n*R*T
Здесь n – количество вещества в молях, T – температура по абсолютной шкале (в кельвинах). Величина R называется универсальной газовой постоянной, которая была введена в это уравнение русским химиком Д. И. Менделеевым, поэтому записанное выражение также называют законом Клапейрона-Менделеева.
Из уравнения выше легко получить формулу давления газа:
P = n*R*T/V
Равенство говорит о том, что давление линейно возрастает с температурой при постоянном объеме и увеличивается по гиперболе с уменьшением объема при постоянной температуре. Эти зависимости отражены в законах Гей-Люссака и Бойля-Мариотта.
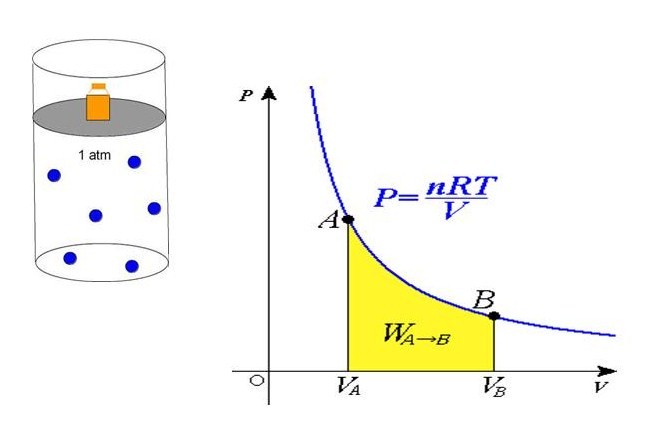
Если сравнить это выражение с записанной выше формулой, которая следует из положений МКТ, то можно установить связь между кинетической энергией одной частицы или всей системы и абсолютной температурой.
Давление в газовой смеси
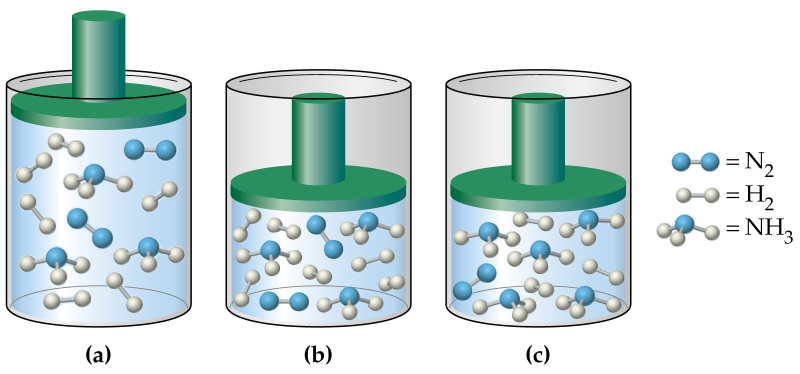
Отвечая на вопрос о том, как найти давление газа и формулы, мы ничего не говорили о том, является ли газ чистым, или речь идет о газовой смеси. В случае формулы для P, которая следует из уравнения Клапейрона, нет никакой связи с химическим составом газа, в случае же выражения для P из МКТ эта связь присутствует (параметр m). Поэтому при использовании последней формулы для смеси газов становится непонятным, какую массу частиц выбирать.
Когда необходимо рассчитать давление смеси идеальных газов, следует поступать одним из двух способов:
- Рассчитывать среднюю массу частиц m или, что предпочтительнее, среднее значение молярной массы M, исходя из атомных процентов каждого газа в смеси;
- Воспользоваться законом Дальтона. Он гласит, что давление в системе равно сумме парциальных давлений всех ее компонентов.
Пример задачи
Известно, что средняя скорость молекул кислорода составляет 500 м/с. Необходимо определить давление в сосуде объемом 10 литров, в котором находится 2 моль молекул.
Ответ на задачу можно получить, если воспользоваться формулой для P из МКТ:
P = N*m*v2/(3*V)
Здесь содержатся два неудобных для выполнения расчетов параметра – это m и N. Преобразуем формулу следующим образом:
m = M/NA;
n = N/NA;
m*N = M*n;
P = M*n*v2/(3*V)
Объем сосуда в кубических метрах равен 0,01 м3. Молярная масса молекулы кислорода M равна 0,032 кг/моль. Подставляя в формулу эти значения, а также величины скорости v и количества вещества n из условия задачи, приходим к ответу: P = 533333 Па, что соответствует давлению в 5,3 атмосферы.
Источник
Давление газа
Давление газа — что это за параметр
Определение
Давление в физике представляет собой один из трех ключевых термодинамических макроскопических характеристик для измерения любой газовой системы.
Определение
Газ — это одно из четырех, включая плазму, агрегатных состояний материи, характеризующееся очень слабыми связями между составляющими его частицами, а также их большой подвижностью.
В газообразной среде частицы в определенной концентрации расположены не упорядоченно и перемещаются в хаотичном порядке в разных направлениях с одинаковой вероятностью. Подобное строение не позволяет газам сохранять стабильность объема и формы даже при малом внешнем силовом воздействии. Для любого газа, включая одноатомный, значение средней кинетической энергии его частиц в виде атомов и молекул будет превышать энергию межмолекулярного взаимодействия между ними.
Кроме того, расстояние, на которое удалены частицы, значительно превышает их собственные размеры. В том случае, когда молекулярными взаимодействиями и габаритами частиц допускается пренебрегать, газ считают идеальным. Для такой формы материи характерен только один тип внутреннего взаимодействия в виде упругих столкновений. Так как размер частиц пренебрежимо мал по сравнению с расстоянием, на которое они удалены, вероятность столкновений частиц между собой будет низкой.
Примечание
По этой причине в идеальной газовой среде можно наблюдать лишь столкновения частиц со стенками сосуда. Какой-либо реальный газ с хорошей точностью можно отнести к идеальному, когда их температура выше, чем комнатная, а давление несущественно больше, чем атмосферное.
Причина возникновения давления в газах
Давление газа нельзя объяснить теми же причинами, что и давление твердого тела на опору. Расстояние, на которое удалены молекулы газообразной среды, существенно больше. В результате хаотичного движения они сталкиваются между собой и со стенками сосуда, который они занимают. Давление газа на стенки сосуда и вызвано ударами его молекул.
Данный параметр увеличивается по мере того, как нарастает сила ударов молекул о стенки. Газ характеризуется одинаковым давлением во всех направлениях, которое является следствием хаотичного движения огромного числа молекул.
Примечание
Важно отметить, что газ оказывает давление на дно и стенки сосуда, объем которого он занимает, во всех направления равномерно. В связи с этим, воздушный шарик сохраняет форму, несмотря на то, что его оболочка достаточно эластична.
Перед тем как транспортировать или отправить на хранение газообразные вещества, их сильно сжимают. В этом случае давление газа увеличивается. Его помещают в специальные баллоны из стали высокой прочности. Такие емкости необходимы для хранения сжатого воздуха на подводных лодках и кислорода, предназначенного для сварки металлов.
Свойства давления газа:
- Если объем уменьшается, то давление газа возрастает, а во время увеличения объема, давление будет снижаться при постоянных величинах массы и температуры вещества.
- Газ, находящийся в закрытом сосуде, характеризуется давлением, которое возрастает по мере увеличения температуры вещества при условии постоянства его массы и объема.
- В том случае, когда масса газа увеличивается, его давление также будет возрастать и наоборот.

Запись формул для определения давления газа начинают с выяснения причин, по которым оно возникает в рассматриваемой системе. Исходя из физического смысла, давление представляет собой величину, равную отношению силы, перпендикулярно воздействующей на некоторое основание, к площади этого основания:
(P=frac{F}{S})
Как было отмечено ранее, для идеальной газовой системы характерен лишь один тип взаимодействия — это абсолютно упругие столкновения. В процессе частицы передают количество движения Δp стенкам сосуда в течение времени соударения Δt. В данном случае применим второй закон Ньютона:
(F*Δt = Δp)
Таким образом, конкретно сила F является причиной формирования давления на стенки сосуда. Данная величина F, производимая одной частицей, незначительна. Однако, когда количество частиц огромно, они в совокупности создают ощутимый эффект, проявляемый в виде наличия давления в сосуде.
Формула давления идеального газа из молекулярно-кинетической теории
Объяснение концепции идеального газа построено на основных положениях молекулярно-кинетической теории, которая вытекает из принципов статистической механики. Наука получила активное развитие во второй половине XIX, благодаря таким ученым, как Джеймс Максвелл и Людвиг Больцман. Основы дисциплины были заложены еще Бернулли в первой половине XVIII века.

Исходя из статистики Максвелла-Больцмана, все частицы в системе обладают разными скоростями движения. При этом можно наблюдать небольшой процент частиц со скоростями, приближенными к нулю, и малую долю частиц, обладающих огромной скоростью. Средняя квадратичная скорость в этом случае будет соответствовать некоторой величине, не изменяющейся с течением времени.
Средняя квадратичная скорость частиц однозначно характеризует температуру газа. Используя приближения молекулярно-кинетической теории в виде невзаимодействующих безразмерных и хаотично движущихся частиц, получают формулу для расчета давления газа в сосуде:
(P=frac{N*m*v^{2}}{3*V})
где N является количеством частиц в системе; V обозначает объем; v представляет собой среднюю квадратичную скорость; m является массой одной частицы.
При наличии указанных в формуле параметров, выраженных в единицах СИ, можно вычислить давление газа в сосуде.
Второй способ записи основного уравнения МКТ
Определение
В середине 30-х годов XIX столетия французскому инженеру Эмилю Клапейрону удалось обобщить накопленный до этого времени экспериментальный опыт изучения поведения газов во время разнообразных изопроцессов и получить формулу, которую в будущем назвали универсальным уравнением состояния идеального газа:
(P*V = n*R*T )
n является количеством вещества в молях; T представляет собой температуру по абсолютной шкале и обозначается в кельвинах.
Величина R является универсальной газовой постоянной. Этот термин был введен в уравнение русским химиком Д.И. Менделеевым. Исходя из этого, запись уравнения называют законом Клапейрона-Менделеева.
Определение
С помощью данного выражения можно определить формулу для расчета давления газа:
(P=frac{n*R*T}{V})
Полученное уравнение объясняет линейный рост давления при увеличении температуры в условиях стабильности объема. Если объем уменьшается с сохранением температуры, то давление увеличивается по гиперболе. Данные закономерности явления отражены в законах Гей-Люссака и Бойля-Мариотта.

Сравнивая представленное выражение с записью формулы, которая вытекает из положений молекулярно-кинетической теории, можно установить связь кинетической энергии одной частицы, либо системы в общем, и абсолютной температуры.

Важно отметить, что при расчетах с использованием формулы для Р, вытекающей из уравнения Клапейрона, связь с химическим составом газа отсутствует. Если давление определяют с помощью выражения, согласно понятию молекулярно-кинетической теории, то данную связь следует учитывать в виде параметра m. В том случае, когда определяют давление смеси идеальных газов, применяют один из следующих методов:
- Расчет средней массы частиц m, либо среднего значения молярной массы М с учетом атомных процентов каждого газа в смеси.
- Применение закона Дальтона, согласно которому давление в системе равно сумме парциальных давлений всех ее компонентов.
Пример
Предположим, что молекулы кислорода движутся со средней скоростью в 500 м/с. Требуется рассчитать, каково давление в сосуде, объем которого равен 10 литров, содержащий 2 моль молекул.
Для того чтобы найти ответ, следует применить формулу для Р из молекулярно-кинетической теории:
(P=frac{N*m*v^{2}}{3*V})
Из-за неизвестных параметров m и N требуется выполнить некоторые преобразования формулы:
(m=frac{M}{NA})
(n=frac{N}{NA})
(m*N= M*n)
(P=frac{M*n*v^{2}}{3*V})
Таким образом, удельный объем сосуда в кубических метрах равен 0,01. Молярная масса молекулы кислорода М составляет 0,032 кг/моль. Данные параметры можно подставить в уравнение вместе со скоростью и количеством вещества. Тогда Р = 533333 Па, что представляет собой давление в 5,3 атмосферы.
Источник
Формула давления — примеры и условия расчетов

Точные науки
Единица измерения давления в физике и химии — буква «Р» (перевод на латинский — «pressūra). Если наблюдается равновесие внутри и снаружи стенок цилиндра, показатель обозначается «П». По международной системе используются Паскали. Используя формулу давления жидкости и силу, можно прийти к выводу, что 1 Па=1 Н/ 1 кв. м. Так как единица мала, применять её в расчётах сложно.
Из таблицы стандартных конвертеров в физике чаще используются обозначения:
- Бары. 1 Бар=105 Па.
- Торры либо мм ртутного столба (1 торр равен 133 Па).
- Мм вод. столба.
Для определения давления используется сила и площадь: Р = mg / S. Существует зависимость величины от объёма и массы. Для показателя характерно следующее свойство: чем меньше площадь, тем большая сила оказывается на тело. Если давление не изменяется, но увеличивается S, тогда искомый показатель уменьшается.
Главные формулы
При изменении условия агрегатного состояния вещества наблюдаются отличные друг от друга свойства. С учётом этого принципа определяется способ вычисления Р. Для гидростатического состояния используется формула: Р = pgh, где:
- р — плотность;
- g — ускорение;
- h — высота.
Гидростатика применяется к газам. Исключение — вычисление АД. Это объясняется разностью высот и плотностей воздушных масс. От глубины погружения предмета либо объекта зависит значение Р вещества. Так как сила F вычисляется путём умножения m на g, а масса воды — p на V, идеальным вариантом для расчёта давления считается выражение: P = pVg / S. Формула применяется на онлайн-ресурсах, где можно решать задачи по физике и химии.
Если площадь записать в виде S= V/h, тогда Р= pgh. Давление в воде либо иной жидкости вычисляется с учётом изменения верхнего слоя. Это приводит к образованию другого Р. Чтобы найти абсолютную силу, используется формула:
Р = Р0 + 2QH, где:
- Р0 — давление неизменяемого слоя;
- Q — поверхность натяжения жидкого вещества;
- H — среднее значение.
Последний показатель должен сообщаться между первыми двумя, поэтому он считается усреднённым. Для определения значения используются радиусы кривизны: ½ (1/R1+ 1/R2). Каждый вид газа оказывает особенное парциальное давление. Для идеального состояния характерна сумма Р каждого отдельного компонента смеси. Частая ошибка, которую допускают школьники при вычислении давления воздуха — применение только кислорода. Но воздух представлен в виде различных газов:
- аргон;
- азот.
Для нахождения давления воздушных масс используется формула P=P1+P2+P3…
Виды величины

Давление может быть различным (избыточным, барометрическим). Абсолютное понятие характерно для вещества либо объекта, на которое не оказывают влияния иные газы. Показатель измеряется в Паскалях. Он вычисляется по следующему калькулятору: нормальное Р = Р2 + Р3 или Р = Р2 — Р4.
Начало отсчёта идёт от планеты Земля, силы внутри сосуда, из которого удалён воздух. Величина используется во многих термодинамических формулах. Для определения гравитации используется понятие барометрическое либо атмосферное давление. Оно изменяется с учётом температуры атмосферы, времени, высоты.
В норме показатель равняется 760 мм рт. ст., при этом температура должна соответствовать нулю по Цельсию. Чем выше находится объект от Земли, тем ниже оказывается на него давление. Значение уменьшается на 100 Па через каждый восьмой километр.
В горах вода закипает быстрее, чем в домашних условиях: давление воздействует на температуру кипения. Если оно снижается, уменьшается t. Зависимость сохраняется и в обратном порядке. На подобном свойстве функционируют некоторые кухонные приборы: скороварка, автоклав. При повышении номинального Р внутри поднимается температура.
Для расчётов применяется стандартная формула, где используются переменные:
- плотность воздушных масс вблизи уровня Земли;
- высота;
- ускорение;
- температура;
- молярная масса.
Если количество частиц задано в молях, используется формула с постоянной величиной К. При проведении расчётов учитывается вероятность изменения температуры, что связано со сменой погоды, набором высоты, географической широтой. Если из атмосферного Р вычесть измеренное, получится избыточная сила. С учётом результата изменяется название показателя:
- положительный — манометрический;
- отрицательный — вакуумметрический.
Последнее значение не может превышать барометрический уровень. Разница давлений в разных точках называется дифференциальным явлением. Его используют, чтобы определить Р на определённом оборудовании. Такое понятие используется в нефтедобывающей отрасли.
Решение задач

В задачах по физике формулы давления могут выглядеть по-разному. Задача первая: нужно найти Р, оказываемое телом на судно и грунт под водой, когда водолаз находится в движении. Человек весит со снаряжением на суше 180 кг. Площадь стопы равняется 360 кв. см. Сила, с которой человек воздействует на судно равно 180/360 = 0.5 (кгс/см). Используя таблицу, величину можно перевести в Па. Получится 49 кПа. На грунт под водой оказывается сила в 2,46 кПа.
Пример 2: нужно вычислить абсолютное Р воды, если глубина равна 150 м, сила — 765, а масса тела — 1,024 кгс/л. Решение: P = 765/735,6+1,024×150/10=16.4.
Пример 3: ёмкость баллона равна 40 л, давление в нём 150 кгс/см2. Нужно найти V свободных воздушных масс. Решение: начальное Р вычисляется следующим образом: 150+1 = 151 кгс/кв.см. Начальное V равно 40 литров. Свободное V вычисляется p1xнач V/p2=6.04 куб. м. Аналогичным способом решаются задачи, где нужно найти Р любой жидкости, твёрдого объекта, газового вещества.
Измерительные приборы
Можно сэкономить время на расчётах, воспользовавшись специальными приборами, функционирующими путём определения давления в соответствующей среде, что схоже с манометром. Их отличия между собой заключаются в инструкции по эксплуатации, сфере использования, точности, области применения.

Чтобы определить АД, понадобится манометр типа барометра. Для определения разряжения (Па меньше атмосферного) понадобится иная разновидность аппарата — вакуумметр. У человека показатель определяется с помощью сфигмоманометра. Большинство пациентов называют такое оборудование неинвазивным тонометром.
Подобные приборы классифицируются на следующие подвиды:
- ртутные механические;
- полуавтоматические;
- автоматические цифровые.

Их погрешность зависит от материалов, используемых в процессе производства и области измерения. Некоторые устройства одновременно измеряют давление и пульс. Они работают автоматически от батареек. За счёт наличия цифрового табло легко узнать результат. Более точными считаются механические.
Чтобы определить Р, понадобится надеть манжет на правую руку больного. Зажав механизм, производится накачка груши. Максимальный и минимальный пределы начинаются с появления, а затем с исчезновения характерного стука. Постепенно механизм ослабляется. Для получения точных данных потребуется опыт работы с механическим тонометром и внимательность. Если наблюдаются колебания давления в воздухе, понадобится дифнамометр либо манометр.
Источник