Какому закону подчиняется давление ненасыщенного пара
Содержание статьи
Насыщенный и ненасыщенный пар
Процессы испарения и конденсации идут непрерывно и параллельно друг другу. В открытом сосуде количество жидкости со временем уменьшается, т.к. испарение преобладает над конденсацией. Пар, который находится над поверхностью жидкости, когда испарение преобладает над конденсацией или пар при отсутствии жидкости, называется ненасыщенным. В герметически закрытом сосуде уровень жидкости со временем не изменяется, т.к. испарение и конденсация компенсируют друг друга: сколько молекул вылетает из жидкости, столько же их за тоже время возвращается в неё, наступает динамическое (подвижное) равновесие между паром и его жидкостью. Пар, который находится в динамическом равновесии со своей жидкостью, называется насыщенным. При данной температуре насыщенный пар какой-либо жидкости имеет наибольшую плотность ( ) и создаёт максимальное давление ( ), которое может иметь пар этой жидкости при этой температуре. Давление и плотность насыщенного пара при одной и той же температуре зависит от рода вещества: большее давление создаёт насыщенный пар той жидкости, которая быстрее испаряется. Например, и Свойства ненасыщенных паров:Ненасыщенные пары подчиняются газовым законам Бойля — Мариотта, Гей-Люссака, Шарля, к ним можно применять уравнение состояния идеального газа. Свойства насыщенных паров:1. При неизменном объёме с возрастанием температуры давление насыщенного пара увеличивается, но не прямо пропорционально (закон Шарля не выполняется), давление растёт быстрее, чем у идеального газа. , при возрастании температуры ( ), увеличивается масса пара, а поэтому возрастает концентрация молекул пара ( ) и давление насыщенного пара растает по двум причинам ( 3 1- ненасыщенный пар (идеальный газ); 2 2 — насыщенный пар; 3 — ненасыщенный пар, 1 полученный из насыщенного пара в том же объёме при нагревании. 2. Давление насыщенного пара при неизменной температуре не зависит от занимаемого им объёма. С увеличением объёма масса пара увеличивается, а масса жидкости уменьшается (часть жидкости переходит в пар), при уменьшении объёма пара становится меньше, а жидкости больше (часть пара переходит в жидкость), плотность же и концентрация молекул насыщенного пара остаются постоянными, следовательно, и давление остаётся постоянным ( ). жидкость (насыщ. пар + жидкость) Ненасыщ. пар Насыщенные пары не подчиняются газовым законам Бойля — Мариотта, Гей-Люссака, Шарля, т.к. масса пара в процессах не остаётся постоянной, а все газовые законы получены для неизменной массы. К насыщенному пару можно применять уравнение состояния идеального газа. Итак, насыщенный пар можно перевести в ненасыщенный пар, либо нагревая его при постоянном объёме, либо увеличивая его объём при постоянной температуре. Ненасыщенный пар можно перевести в насыщенный пар, либо охлаждая его при постоянном объёме, либо сжимая его при постоянной температуре. Критическое состояние Наличие свободной поверхности у жидкости даёт возможность указать, где находится жидкая фаза вещества, а где газообразная. Резкое различие между жидкостью и её паром объясняется тем, что плотность жидкости во много раз больше, чем у пара. Если нагревать жидкость в герметически закрытом сосуде, то вследствие расширения её плотность будет уменьшаться, а плотность пара над ней увеличиваться. Это означает, что различие между жидкостью и её насыщенным паром сглаживается и при достаточно высокой температуре исчезает совсем. Температура, при которой исчезают различия в физических свойствах между жидкостью и её насыщенным паром, и их плотности становятся одинаковыми, называется критической температурой. критическая точка Для образования жидкости из газа средняя потенциальная энергия притяжения молекул должна превышать их среднюю кинетическую энергию. Критическая температура — максимальная температура, при которой пар превращается в жидкость. Критическая температура зависит от потенциальной энергии взаимодействия молекул и поэтому различна для разных газов. Из-за сильного взаимодействия молекул воды водяной пар можно превратить в воду даже при температуре . В то же время сжижение азота происходит лишь при температуре, меньшей =-147˚ , т.к. молекулы азота слабо взаимодействуют между собой. Другим макроскопическим параметром, влияющим на переход пар — жидкость, является давление. С ростом внешнего давления при сжатии газа уменьшается среднее расстояние между частицами, возрастает сила притяжения между ними и соответственно средняя потенциальная энергия их взаимодействия. Давление насыщенного пара при его критической температуре называется критическим. Это наибольшее возможное давление насыщенного пара данного вещества. Состояние вещества с критическими параметрами называется критическим(критическая точка).У каждого вещества свои критические температура и давление. В критическом состоянии обращаются в нуль удельная теплота парообразования и коэффициент поверхностного натяжения жидкости. При температурах выше критической, даже при очень больших давлениях невозможно превращение газа в жидкость, т.е. выше критической температуры жидкость не может существовать. При сверхкритических температурах возможно только парообразное состояние вещества. Сжижение газов возможно лишь при температурах ниже критической температуры. Для сжижения газы охлаждают до критической температуры, например, при адиабатном расширении, а затем изотермически сжимают. Кипение Внешне явление выглядит так: со всего объёма жидкости к поверхности поднимаются быстро растущие пузырьки, на поверхности они лопаются, и пар выбрасывается в окружающую среду. МКТ объясняет кипение так: в жидкости всегда есть пузырьки воздуха, в них из жидкости происходит испарение. Замкнутый объём пузырьков оказывается заполненным не только воздухом, но и насыщенным паром. Давление насыщенного пара в них при нагревании жидкости растёт быстрее, чем давление воздуха. Когда в достаточно нагретой жидкости давление насыщенного пара в пузырьках становится больше внешнего давления, они увеличиваются в объёме, и выталкивающая сила, превосходящая их силу тяжести, поднимает пузырьки к поверхности. Всплывшие пузырьки начинают лопаться, когда при определённой температуре давление насыщенного пара в них превосходит давление над жидкостью. Температура жидкости, при которой давление её насыщенного пара в пузырьках равно или превышает внешнее давление на жидкость, называется температурой кипения. Температура кипения различных жидкостей различна, т.к. давление насыщенного пара в их пузырьках сравнивается с одним и тем же внешним давлением при разных температурах. Например, давление насыщенного пара в пузырьках равно нормальному атмосферному давлению у воды при 100˚С, у ртути при 357˚С, у спирта при 78˚С, у эфира при 35˚С. Температура кипения в процессе кипения остаётся постоянной, т.к. всё тепло, которое подводится к нагреваемой жидкости, тратится на парообразование. Температура кипения зависит от внешнего давления на жидкость: с увеличением давления температура повышается; с уменьшением давления температура понижается. Например, на высоте 5км над уровнем моря, где давление в 2 раза ниже атмосферного, температура кипения воды 83˚С, в котлах паровых машин, где давление пара 15 атм. ( ), температура воды около 200˚С. Влажность воздуха В воздухе всегда есть водяной пар, поэтому можно говорить о влажности воздуха, которая характеризуется следующими величинами: 1.Абсолютная влажность — это плотность водяного пара, находящегося в воздухе ( или давление, которое этот пар создаёт ( . Абсолютная влажность не даёт представление о степени насыщения воздуха водяными парами. Одно и то же количество водяного пара при разной температуре создаёт разное ощущение влажности. 2.Относительная влажность — это отношение плотности (давления) водяного пара, содержащегося в воздухе при данной температуре, к плотности (давлению) насыщенного пара при той же температуре : или — абсолютная влажность при данной температуре; — плотность, давление насыщенного пара при той же температуре. Плотность и давление насыщенного водяного пара при любой температуре можно найти в таблице. Из таблицы видно, чем выше температура воздуха, тем больше должны быть плотность и давление водяного пара в воздухе, чтобы он был насыщенным. Зная относительную влажность, можно понять, на сколько процентов водяной пар в воздухе при данной температуре далёк от насыщения. Если пар в воздухе насыщенный, то . Если ,то до состояния насыщения в воздухе не хватает пара. О том, что пар в воздухе становится насыщенным, судят по появлению влаги в виде тумана, росы. Температура, при которой водяной пар в воздухе становится насыщенным, называется точкой росы. Пар в воздухе можно сделать насыщенным, если добавить пары за счёт дополнительного испарения жидкости, не меняя температуры воздуха, или при имеющемся количестве пара в воздухе понизить его температуру. Нормальная относительная влажность, наиболее благоприятная для человека 40 — 60%. Большое значение имеет знание влажности в метеорологии для предсказания погоды. В ткацком, кондитерском производстве для нормального течения процесса необходима определённая влажность. Хранение произведений искусства и книг требует поддержания влажности воздуха на необходимом уровне. Приборы для определения влажности: 1. Конденсационный гигрометр (позволяет определить точку росы). 2. Волосной гигрометр (принцип действия основан на зависимости длины обезжиренного волоса от влажности) измеряет относительную влажность в процентах. 3. Психрометр состоит из двух термометров сухого и увлажнённого. Резервуар увлажнённого термометра обмотан тканью, опущенной в воду. За счёт испарения с ткани температура увлажнённого ниже, чем сухого. Разность показаний термометров зависит от влажности окружающего воздуха: чем суше воздух, тем интенсивнее испарение с ткани, тем больше разность показаний термометров и наоборот. Если влажность воздуха 100%, то показания термометров одинаковые, т.е. разность показаний 0. Для определения влажности с помощью психрометра используют психрометрическую таблицу. Плавление и кристаллизация При плавлении твёрдого тела увеличивается расстояние между частицами, образующими кристаллическую решётку, и происходит разрушение самой решётки. На процесс плавления необходимо затрачивать энергию. При нагревании твёрдого тела возрастает кинетическая энергия колеблющихся молекул и соответственно амплитуда их колебаний. При определённой температуре, называемой температурой плавления, нарушается порядок в расположении частиц в кристаллах, кристаллы теряют свою форму. Вещество плавится, переходя из твёрдого состояния в жидкое состояние. При кристаллизациипроисходит сближение молекул, которые образуют кристаллическую решётку. Кристаллизация может происходить только тогда, когда жидкость отдаёт энергию. При охлаждении расплавленного вещества средняя кинетическая энергия и скорость молекул уменьшаются. Силы притяжения могут удерживать частицы около положения равновесия. При определённой температуре, называемой температурой отвердевания (кристаллизации),все молекулы оказываются в положении устойчивого равновесия, их расположение становится упорядоченным — образуется кристалл. Плавление твёрдого тела происходит при той же температуре, при которой это вещество отвердевает Каждое вещество имеет свою температуру плавления. Например, температуры плавления у гелия -269,6˚С, у ртути -38,9˚С, у меди 1083˚С. Во время процесса плавления температура остаётся постоянной. Подводимое извне количество теплоты идёт на разрушение кристаллической решётки. Во время процесса отвердевания, не смотря на то, что тепло отводится, температура не меняется. Выделяющаяся при кристаллизации энергия расходуется на поддержание постоянной температуры. Пока всё вещество не расплавится или всё вещество не отвердеет, т.е. пока существуют совместно твёрдая и жидкая фазы вещества, температура не изменяется. жид. жид. тв.+жид. жид.+тв. тв. тв. ,где — количество теплоты, — количество теплоты, необходимое для расплавления вещества выделяемое при кристаллизации вещества массой массой — удельная теплота плавления- количество теплоты, необходимое для плавления вещества массой 1кг при температуре плавления. Какое количество теплоты затрачивается при плавлении определённой массы вещества, такое же количество теплоты выделяется при кристаллизации этой массы. называется также удельной теплотой кристаллизации. При температуре плавления внутренняя энергия вещества в жидком состоянии больше внутренней энергии такой же массы вещества в твёрдом состоянии. У большого числа веществ объём при плавлении увеличивается, а плотность уменьшается. При отвердевании наоборот, объём уменьшается, а плотность увеличивается. Например, кристаллики твёрдого нафталина тонут в жидком нафталине. Некоторые вещества, например, висмут, лёд, галлий, чугун и др. при плавлении сжимаются, а при отвердевании расширяются. Эти отклонения от общего правила объясняются особенностями строения кристаллических решёток. Поэтому вода оказывается плотнее льда, лёд плавает в воде. Расширение воды при замерзании ведёт к разрушению горных пород. Изменение объёма металлов при плавлении и отвердевании имеет существенное значение в литейном деле. Опыт показывает, что изменение внешнего давления на твёрдое вещество отражается на температуре плавления этого вещества. Для тех веществ, которые при плавлении расширяются, увеличение внешнего давления приводит к повышению температуры плавления, т.к. затрудняет процесс плавления. Если же вещества при плавлении сжимаются, то для них увеличение внешнего давления ведёт к понижению температуры плавления, т.к. помогает процессу плавления. Только очень большое увеличение давления заметно изменяет температуру плавления. Например, чтобы понизить температуру плавления льда на 1˚С, давление нужно повысить на 130 атм. Температуру плавления вещества при нормальном атмосферном давлении называют точкой плавления вещества. Рекомендуемые страницы:
|
Источник
Учебники
Над свободной поверхностью жидкости всегда имеются пары этой жидкости. Если сосуд с жидкостью не закрыт, то всегда найдутся молекулы пара, которые удаляются от поверхности жидкости и не могут вернуться назад в жидкость. В закрытом сосуде одновременно с испарением жидкости происходит конденсация пара. Сначала число молекул, вылетающих из жидкости за 1 с, больше числа молекул, возвращающихся обратно, и плотность, а значит, и давление пара растет. Число молекул пара возрастает до тех пор, пока число молекул, покинувших жидкость (испарившихся), не станет равно числу молекул, возвратившихся у жидкость (сконденсировавшихся) за один и тот же промежуток времени. Такое состояние называют динамическим равновесием.
Пар, находящийся в состоянии динамического равновесия со своей жидкостью, называется насыщенным паром. Для описания насыщенного пара применяют следующие величины: давление насыщенного пара pн и плотность насыщенного пара ρн. При данной температуры насыщенный пар обладает максимально возможным значением давления и плотности пара.
Пар, давление которого меньше давления насыщенного пара при данной температуре, называется ненассыщенным. Аналогично можно было дать определение и через плотность пара.
Опыт показывает, что ненасыщенные пары подчиняются всем газовым законам, и тем точнее, чем дальше они от насыщения.
Свойства насыщенных паров
Для насыщенных паров характерны следующие свойства:
- плотность и давление насыщенного пара зависят от рода вещества. Чем меньше удельная теплота парообразования жидкости, тем быстрее она испаряется и тем больше давление и плотность ее паров;
- давление и плотность насыщенного пара однозначно определяются его температурой (не зависят от того, каким образом пар достиг этой температуры: при нагревании или при охлаждении);
- в замкнутом сосуде (V = const) давление и плотность пара быстро возрастают с увеличением температуры (рис. 1, а, б). Более сильное увеличение давления насыщенного пара по сравнению с идеальным газом объясняется тем, что здесь происходит рост давления не только за счет роста средней кинетической энергии молекул (как у идеального газа), но и за счет увеличения концентрации молекул (было замечено, что при нагревании уровень жидкости в закрытом сосуде понижается, следовательно, масса и плотность пара возрастают). Таким образом, газовый закон для изохорного процесса не применим к насыщенному пару.
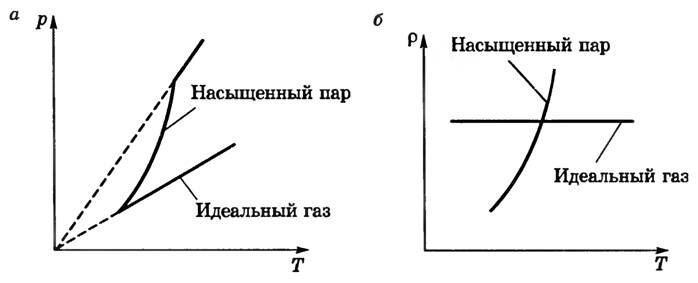
Рис. 1
- при постоянной температуре давление и плотность насыщенного пара не зависят от объема. На рисунке 2 для сравнения приведены изотермы идеального газа (а) и насыщенного пара (б). Опыт показывает, что при изотермическом расширении уровень жидкости в сосуде понижается, при сжатии — повышается, т.е. изменяется число молекул пара так, что плотность пара остается постоянной. Таким образом, газовый закон для изотермического процесса также не применим к насыщенному пару;
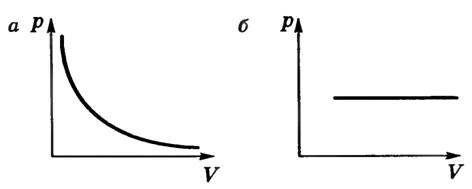
Рис. 2
- уравнение p = n⋅k⋅T описывает состояние насыщенного пара только приближенно.
Следовательно, насыщенный пар не подчиняется газовым законам идеального газа. Значения давления и плотности насыщенного пара при заданной температуре определяются из таблиц (см. таблицу).
Таблица. Давление (р) и плотность (ρ) насыщенных паров воды при различных температурах (t).
| t, °С | р, кПа | ρ, г/м3 |
|---|---|---|
| 0,611 | 4,84 | |
| 20 | 2,34 | 17,3 |
| 40 | 7,37 | 51,2 |
| 60 | 19,9 | 130 |
| 80 | 47,3 | 293 |
| 100 | 101,3 | 598 |
| 120 | 196 | 1122 |
В результате испарения воды с многочисленных водоемов (морей, озер, рек и др.), а также с растительных покровов в атмосферном воздухе всегда содержится водяной пар. От количества водяного пара, содержащегося в воздухе, зависит погода, самочувствие человека, функционирование многих его органов, жизнь растений, а также сохранность технических объектов, архитектурных сооружений, произведений искусств. Поэтому очень важно следить за влажностью воздуха, уметь измерять ее.
Водяной пар в воздухе обычно является ненасыщенным. Перемещение воздушных масс, обусловленное в конечном счете излучением Солнца, приводит к тому, что в одних местах нашей планеты в данный момент испарение воды преобладает над конденсацией, а в других, наоборот, преобладает конденсация.
Воздух, содержащий водяные пары, называют влажным. Для характеристики содержания водяного пара в воздухе вводят ряд величин: абсолютную влажность и относительную влажность.
Абсолютной влажностью ρ воздуха называют величину, численно равную массе водяного пара, содержащегося в 1 м3 воздуха (т.е. плотность водяного пара в воздухе при данных условиях).
В СИ единицей абсолютной влажности является килограмм на кубический метр (кг/м3). Иногда используются внесистемные единицы грамм на кубический метр (г/м3).
Абсолютная влажность ρ и давление p водяного пара связаны между собой уравнением состояния
(~p cdot V = dfrac {m cdot M}{R cdot T} Rightarrow p = dfrac{rho}{M} cdot R cdot T)
Если известна только абсолютная влажность, еще нельзя судить, насколько сух или влажен воздух. Для определения степени влажности воздуха необходимо знать, близок или далек водяной пар от насыщения.
Относительной влажностью воздуха φ называют выраженное в процентах отношение абсолютной влажности к плотности ρ0 насыщенного пара при данной температуре (или отношение давления p водяного пара к давлению p0 насыщенного пара при данной температуре):
(~varphi = dfrac{rho}{rho_0} cdot 100;%, ;; ~varphi = dfrac{p}{p_0} cdot 100;%.)
Чем меньше относительная влажность, тем дальше пар от насыщения, тем интенсивнее происходит испарение. Давление насыщенного пара p0 при заданной температуре — величина табличная. Давление p водяного пара (а значит, и абсолютную влажность) определяют по точке росы.
Пусть при температуре t1 давление водяного пара p1. Состояние пара на диаграмме р, t изобразится точкой А (рис. 5).
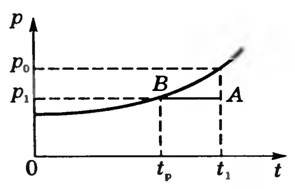
Рис. 5
При изобарном охлаждении до температуры tp пар становится насыщенным и его состояние изобразится точкой В. Температуру tp, при которой водяной пар становится насыщенным, называют точкой росы. При охлаждении ниже точки росы начинается конденсация паров: появляется туман, выпадает роса, запотевают окна. Точка росы позволяет определить давление водяного пара p1, находящегося в воздухе при температуре t1.
Действительно, из рисунка 5 видим, что давление p1 равно давлению насыщенного пара при точке росы p1 = p0tp . Следовательно, (~varphi = dfrac{p_{0tp}}{p_0} cdot 100 ;%)
Психрометр. Гигрометр
При понижении температуры, относительная влажность воздуха увеличивается. При некоторой температуре (точке росы) водяной пар становится насыщенным. Дальнейшее понижение температуры приводит к тому, что образующийся излишек водяных паров начинает конденсироваться в виде капелек росы или тумана.
Для определения относительной влажности воздуха, можно искусственно понизить температуру воздуха в какой-то ограниченной области до точки росы. Абсолютная влажность и, соответственно, давление водяных паров при этом останутся неизменными. Сравнивая давление водяного пара при точке росы с давлением насыщенного пара, которое могло бы быть при интересующей нас температуре, мы тем самым, найдем относительную влажность воздуха. Быстрого охлаждения можно добиться при интенсивном испарении какой-нибудь летучей жидкости. Такой метод применяют для измерении влажности при помощи конденсационного гигрометра.
Конденсационный гигрометр состоит из металлической коробочки с двумя отверстиями (рис. 6).
Рис. 6
В коробочку заливается эфир. С помощью резиновой груши через коробочку прокачивается воздух. Эфир очень быстро испаряется, температура коробочки и воздуха, находящегося вблизи нее, понижается, а относительная влажность растет. При некоторой температуре, которая измеряется термометром, вставленным в отверстие прибора, поверхность коробочки покрывается мельчайшими капельками росы. Чтобы точнее зафиксировать момент появления на поверхности коробочки росы, эта поверхность полируется до зеркального блеска, а рядом с коробочкой для контроля располагается отполированное металлическое кольцо.
В современных конденсационных гигрометрах для охлаждения зеркальца пользуются полупроводниковым элементом, принцип действия которого основан на Пельтье эффекте, а температура зеркальца измеряется вмонтированным в него проволочным сопротивлением или полупроводниковым микротермометром.
Действие волосного гигрометра основано на свойстве обезжиренного человеческого волоса изменять свою длину при изменении влажности воздуха, что позволяет измерять относительную влажность от 30 до 100%. Волос 1 (рис. 7) натянут на металлическую рамку 2. Изменение длины волоса передаётся стрелке 3, перемещающейся вдоль шкалы.
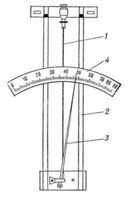
а

б
Рис. 7
Действие керамического гигрометра основано на зависимости электрического сопротивления твердой и пористой керамической массы (смесь глины, кремния, каолина и некоторых окислов металла) от влажности воздуха.
Относительную влажность определяют также с помощью психрометра.
Психрометр состоит из двух термометров, шарик одного из них обмотан тканью, нижние концы которой опущены в сосуд с дистиллированной водой (рис. 8). Сухой термометр регистрирует температуру воздуха, а влажный — температуру испаряющейся воды. Но при испарении жидкости ее температура понижается. Чем суше воздух (меньше его относительная влажность), тем интенсивнее испаряется вода из влажной ткани и тем ниже ее температура. Следовательно, разность показаний сухого и влажного термометров (так называемая психрометрическая разность) зависит от относительной влажности воздуха. Зная эту разность температур, определяют относительную влажность воздуха по специальным психрометрическим таблицам.
Рис. 8
- Гигрометр — от греч.Hygros — влажный.
- Психрометр — от греч.Psychros — холодный + Metreo — измеряю
См. также
- Гигрометр Wikipedia.org
- Измерители влажности воздуха и газов (гигрометр ВИТ, гигрометр электронный, гигрометр психометрический …)
- Относительная влажность Wikipedia.org
- Психрометр Wikipedia.org
- Аксенович Л. А. Физика в средней школе: Теория. Задания. Тесты: Учеб. пособие для учреждений, обеспечивающих получение общ. сред, образования / Л. А. Аксенович, Н.Н.Ракина, К. С. Фарино; Под ред. К. С. Фарино. — Мн.: Адукацыя i выхаванне, 2004. — C. 197-203.
- Жилко В.В. Физика: Учеб. пособие для 11-го кл. общеобразоват. шк. с рус. яз. обучения / В.В. Жилко, А.В.Лавриненко, Л.Г. Маркович. — Мн.: Нар. асвета, 2002. — С. 194-203.
- Открытая Физика
Источник
