Какое осмотическое давление должны иметь растворы которые используются в
Содержание статьи
смотическое давление. Осмоляльность и осмоль
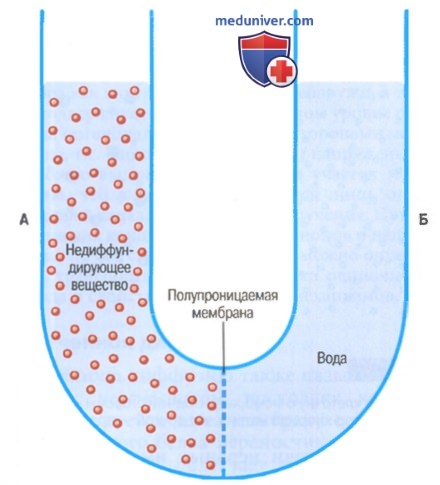
Осмотическое давление. Осмоляльность и осмольЕсли в условиях, к раствору хлорида натрия приложить давление, осмос воды в этот раствор замедлится, прекратится или пойдет в противоположном направлении. Точную величину давления, необходимого для прекращения осмоса, называют осмотическим давлением раствора хлорида натрия. Принцип перепада давления, противостоящего осмосу, демонстрируется на рисунке, где показана избирательно проницаемая мембрана, разделяющая два столба жидкости, один из которых содержит чистую воду, а другой — воду и любое растворенное вещество, не проникающее через мембрану. Осмос воды из отсека Б в отсек А ведет ко все большему перепаду уровней столбов жидкости до тех пор, пока в итоге разность давлений по обе стороны мембраны не станет достаточно большой, чтобы противостоять осмотическому эффекту. Разность давлений через мембрану в этот момент эквивалентна осмотическому давлению раствора, содержащего не проникающее через мембрану вещество. Значение количества осмотических частиц (молярной концентрации) в определении осмотического давления. Осмотическое давление, создаваемое растворенными частицами, независимо от того, являются ли они молекулами или ионами, определяется количеством частиц на единицу объема жидкости, но не их массой, т.к. каждая частица в растворе, независимо от ее массы, оказывает в среднем одинаковое давление на мембрану.
Так, большие частицы, имеющие большую массу (т), движутся с меньшей скоростью (v), чем малые частицы. Малые частицы движутся с более высокой скоростью, и средняя кинетическая энергия (к), определяемая уравнением: k=mv2/2, одинакова как для каждой малой, так и каждой большой частицы. Следовательно, фактором, определяющим осмотическое давление раствора, является его концентрация, выраженная количеством частиц (что для недиссоциирующих веществ аналогично молярной концентрации), но не показателем массы растворенного вещества. Один осмоль является 1 грамм-молекулой осмотически активного растворенного вещества. Так, 180 г глюкозы, т.е. 1 грамм-молекула глюкозы, эквивалентны 1 осмолю глюкозы, поскольку глюкоза не диссоциирует на ионы. Если растворенное вещество диссоциирует на 2 иона, 1 грамм-молекула растворенного вещества будет соответствовать 2 осмолям, поскольку число осмотически активных частиц в этом случае вдвое больше, чем для недиссоциирующего вещества. Следовательно, о растворе, содержащем 1 осмоль растворенного вещества в каждом килограмме воды, говорят, что его осмоляльность равна 1 осмоль на 1 кг. Раствор, содержащий 1/1000 осмоля растворенного вещества на 1 кг, имеет осмоляльность 1 миллиосмоль (мосм) на 1 кг. Нормальная осмоляльность внеклеточной и внутриклеточной жидкостей равна примерно 300 мосм на 1 кг воды. Связь осмоляльности с осмотическим давлением. При 37°С, т.е. при температуре, равной нормальной температуре тела, раствор с концентрацией 1 осмоль на 1 л воды создает осмотическое давление, равное 19300 мм. рт. ст. Следовательно, концентрация 1 моем на 1 л эквивалентна 79,3 мм. рт. ст. осмотического давления. Умножение этой величины на 300 мосм, т.е. на концентрацию частиц в жидкостях организма, дает общее расчетное осмотическое давление, равное 5790 мм рт. ст., однако измеренная реальная величина давления составляет в среднем только 5500 мм рт. ст. Причина такого различия заключается в том, что многие ионы в жидкостях организма, например ионы натрия и хлора, сильно притягиваются друг к другу и, следовательно, не могут двигаться совершенно свободно, реализуя свой полный осмотический потенциал. Термин «осмолярность». В связи со сложностью измерения воды в растворе в килограммах, что необходимо для определения осмоляльности, вместо этого показателя используют осмолярность, т.е. осмолярную концентрацию, выражаемую числом осмолей на 1 л раствора, а не количеством осмолей на 1 кг воды. Хотя, строго говоря, именно осмоли на 1 кг воды (осмоляльность) определяют осмотическое давление для таких разбавленных растворов, как жидкости организма, количественные различия между осмолярностью и осмоляльностью составляют менее 1%. — Также рекомендуем «Активный транспорт веществ через мембраны. Натрий-калиевый насос» Оглавление темы «Транспорт ионов и мембранные потенциалы клетки»: |
Источник
Помогите с тестами!!!! СРОЧНО!!!! Коллигативные свойства растворов
Пользователь
Ранг: 1
Завтра зачет!!!Подскажите, правильные ответы!!!!У меня получились такие ответы на тесты:
1 А
2 Б
3 Б
4 Б
5 В
6 Б
7 Б
8 А
9 Б
10 Б
11 Г
12 Б
13 А
14 А
15 Г
16 А
17 Г
18 В
19 Б
20 В
21 Б
22 А
23 В
24 Б
25 В
Коллигативные свойства
1 Осмос – это:
А Односторонняя самопроизвольная диффузия молекул растворителя через полупроницаемую мембрану в раствор.
Б Односторонняя самопроизвольная диффузия молекул растворителя из раствора с высокой концентрацией в раствор с низкой концентрацией.
В Односторонняя самопроизвольная диффузия молекул растворяемого вещества из раствора с низкой концентрацией в раствор с высокой концентрацией.
Г Давление, которое необходимо приложить к раствору, прекратить диффузию через полупроницаемую мембрану.
2 Одинаковое ли осмотическое давление будут иметь растворы сахарозы, калия хлорида, натрия сульфата одинаковой молярной концентрации при одинаковой температуре?
А Одинаковое
Б Различное
В Зависит от атмосферного давления
Г Одинаковое при любой температуре
3 Для уничтожения бактерий, вызывающих ботулизм, в качестве консерванта используется раствор с высоким содержанием сахара. С чем это связано?
А С нарушением подвижности бактерий.
Б С явлением плазмолиза.
В С явлением гемолиза.
Г С явлением изоосмоса.
4 Какие электролиты будут иметь одинаковое осмотическое давление при одинаковой температуре и молярной концентрации.
А Na2SO4 и NaCl
Б NaCl и KCl
В CaCl2 и KCl
Г NaCl и BaCl2
5 Какое из следующих свойств относится к коллигативным?
А Температура кипения растворителя
Б Электролитическая диссоциация
В Температура кипения раствора по сравнению с чистым растворителем.
Г Растворимость веществ.
6 Плазмолиз живой клетки происходит, если поместить её в:
А 0.9 % раствор NaCl
Б 10 % раствор NaCl
В Дистиллированную воду
Г 1 % раствор NaCl
7 Одинаковое ли осмотическое давление будут иметь растворы натрия хлорида, кальция хлорида, фруктозы при одной и той же температуре и одинаковой молярной концентрации?
А Одинаковое
Б Различное
В Зависит от атмосферного давления
Г Одинаковое при любой температуре
8 Для какого из растворов NaCl осмотическое давление будет наибольшим:
А С(NaCl) = 0,1 моль/л
Б С(NaCl) = 0,0001 моль/л
В С(NaCl) = 0,01 моль/л
Г С(NaCl) = 0,001 моль/л
9 Для какого из растворов изотонический коэффициент будет наибольшим:
А С(NaCl) = 0,1 моль/л
Б С(NaCl) = 0,0001 моль/л
В С(NaCl) = 0,01 моль/л
Г С(NaCl) = 0,001 моль/л
10 Для какого из электролитов изотонический коэффициент будет наибольшим:
А С(NaCl) = 0,01 моль/л
Б С(K2SO4) = 0,01 моль/л
В С(KCl) = 0,01 моль/л
Г С (MgSO4) = 0,01 моль/л
11 Для какого из водных растворов температура замерзания будет наименьшей:
А Сm (NaCl) = 0,01 моль/кг
Б Сm (K2SO4) = 0,01 моль/кг
В Сm (KCl) = 0,01 моль/кг
Г Сm (MgSO4) = 0,01 моль/кг
12 Для какого из водных растворов температура замерзания будет наибольшей:
А Сm (СaCl2 ) = 0,1 моль/кг
Б Сm (LiNO3) = 0,1 моль/кг
В Сm (глюкозы) = 0,1 моль/кг
Г Сm (K2SO4) = 0,1 моль/кг
13 Для какого из водных растворов температура замерзания будет наименьшей:
А Сm (глюкозы ) = 0,1 моль/кг
Б Сm (LiNO3) = 0,1 моль/кг
В Сm (сахарозы) = 0,1 моль/кг
Г Сm (фруктозы) = 0,1 моль/кг
14 Для какого из водных растворов температура кипения будет наибольшей:
А Сm (FeCl3) = 0,01 моль/кг
Б Сm (KCl) = 0,01 моль/кг
В Сm (K2SO4) = 0,01 моль/кг
Г Сm (NaCl) = 0,01 моль/кг
15 Для какого из водных растворов температура кипения будет наибольшей:
А Сm (NaNO3) = 0,01 моль/кг
Б Сm (NaClO4) = 0,01 моль/кг
В Сm (Na2SO4) = 0,01 моль/кг
Г Сm (AlCl3) = 0,01 моль/кг
16 Какой из растворов хлорида натрия будет гипотоническим по отношению к крови:
А ω (NaCl) = 0,009
Б ω (NaCl) = 0,9
В ω (NaCl) = 0,00009
Г ω (NaCl) = 0,09
17 Какой из растворов хлорида натрия будет гипертоническим по отношению к крови:
А ω (NaCl) = 0,009
Б ω (NaCl) = 0,0009
В ω (NaCl) = 0,00009
Г ω (NaCl) = 0,09
18 Какой из растворов при to 37oC имеет меньшее осмотическое давление:
А С (СaCl2 ) = 0,1 моль/л
Б С (LiNO3) = 0,1 моль/л
В С (глюкозы) = 0,1 моль/л
Г С (K2SO4) = 0,1 моль/л
19 Какое осмотическое давление должны иметь растворы, которые используются в медицинской практике как изотонические растворы или кровезаменители:
А 500-600 кПа
Б 740-800 кПа
В 800-900 кПа
Г 400-500 кПа
20 Чему будет равняться изотонический коэффициент Вант-Гоффа для хлорида кальция, если это вещество полностью продиссоциировало в водном растворе:
А i = 1
Б i = 2
В i = 3
Г i = 4
21 Чему будет равняться изотонический коэффициент Вант-Гоффа для хлорида калия, если это вещество полностью продиссоциировало в водном растворе:
А i = 1
Б i = 2
В i = 3
Г i = 4
22 Осмотическое давление раствора можно рассчитать пользуясь:
А Законом Вант-Гоффа
Б 1-м законом Рауля
В 2-м законом Рауля
Г Законом Генри
23 Изменение температуры кипения раствора можно рассчитать пользуясь:
А Законом Вант-Гоффа
Б 1-м законом Рауля
В 2-м законом Рауля
Г Законом Генри
24 Изменение давления пара над раствором можно рассчитать пользуясь:
А Законом Вант-Гоффа
Б 1-м законом Рауля
В 2-м законом Рауля
Г Законом Генри
25 Чему будет равняться изотонический коэффициент Вант-Гоффа для сульфида калия, если это вещество полностью продиссоциировало в водном растворе:
А i = 1
Б i = 2
В i = 3
Г i = 4
Источник
Какое осмотическое давление должны иметь растворы которые используются в
Пользователь
Ранг: 1
1 А
2 Б
3 Б
4 Б
5 В
6 Б
7 Б
8 А
9 Б
10 Б
11 Г
12 Б
13 А
14 А
15 Г
16 А
17 Г
18 В
19 Б
20 В
21 Б
22 А
23 В
24 Б
25 В
Коллигативные свойства
1 Осмос – это:
А Односторонняя самопроизвольная диффузия молекул растворителя через полупроницаемую мембрану в раствор.
Б Односторонняя самопроизвольная диффузия молекул растворителя из раствора с высокой концентрацией в раствор с низкой концентрацией.
В Односторонняя самопроизвольная диффузия молекул растворяемого вещества из раствора с низкой концентрацией в раствор с высокой концентрацией.
Г Давление, которое необходимо приложить к раствору, прекратить диффузию через полупроницаемую мембрану.
2 Одинаковое ли осмотическое давление будут иметь растворы сахарозы, калия хлорида, натрия сульфата одинаковой молярной концентрации при одинаковой температуре?
А Одинаковое
Б Различное
В Зависит от атмосферного давления
Г Одинаковое при любой температуре
3 Для уничтожения бактерий, вызывающих ботулизм, в качестве консерванта используется раствор с высоким содержанием сахара. С чем это связано?
А С нарушением подвижности бактерий.
Б С явлением плазмолиза.
В С явлением гемолиза.
Г С явлением изоосмоса.
4 Какие электролиты будут иметь одинаковое осмотическое давление при одинаковой температуре и молярной концентрации.
А Na2SO4 и NaCl
Б NaCl и KCl
В CaCl2 и KCl
Г NaCl и BaCl2
5 Какое из следующих свойств относится к коллигативным?
А Температура кипения растворителя
Б Электролитическая диссоциация
В Температура кипения раствора по сравнению с чистым растворителем.
Г Растворимость веществ.
6 Плазмолиз живой клетки происходит, если поместить её в:
А 0.9 % раствор NaCl
Б 10 % раствор NaCl
В Дистиллированную воду
Г 1 % раствор NaCl
7 Одинаковое ли осмотическое давление будут иметь растворы натрия хлорида, кальция хлорида, фруктозы при одной и той же температуре и одинаковой молярной концентрации?
А Одинаковое
Б Различное
В Зависит от атмосферного давления
Г Одинаковое при любой температуре
8 Для какого из растворов NaCl осмотическое давление будет наибольшим:
А С(NaCl) = 0,1 моль/л
Б С(NaCl) = 0,0001 моль/л
В С(NaCl) = 0,01 моль/л
Г С(NaCl) = 0,001 моль/л
9 Для какого из растворов изотонический коэффициент будет наибольшим:
А С(NaCl) = 0,1 моль/л
Б С(NaCl) = 0,0001 моль/л
В С(NaCl) = 0,01 моль/л
Г С(NaCl) = 0,001 моль/л
10 Для какого из электролитов изотонический коэффициент будет наибольшим:
А С(NaCl) = 0,01 моль/л
Б С(K2SO4) = 0,01 моль/л
В С(KCl) = 0,01 моль/л
Г С (MgSO4) = 0,01 моль/л
11 Для какого из водных растворов температура замерзания будет наименьшей:
А Сm (NaCl) = 0,01 моль/кг
Б Сm (K2SO4) = 0,01 моль/кг
В Сm (KCl) = 0,01 моль/кг
Г Сm (MgSO4) = 0,01 моль/кг
12 Для какого из водных растворов температура замерзания будет наибольшей:
А Сm (СaCl2 ) = 0,1 моль/кг
Б Сm (LiNO3) = 0,1 моль/кг
В Сm (глюкозы) = 0,1 моль/кг
Г Сm (K2SO4) = 0,1 моль/кг
13 Для какого из водных растворов температура замерзания будет наименьшей:
А Сm (глюкозы ) = 0,1 моль/кг
Б Сm (LiNO3) = 0,1 моль/кг
В Сm (сахарозы) = 0,1 моль/кг
Г Сm (фруктозы) = 0,1 моль/кг
14 Для какого из водных растворов температура кипения будет наибольшей:
А Сm (FeCl3) = 0,01 моль/кг
Б Сm (KCl) = 0,01 моль/кг
В Сm (K2SO4) = 0,01 моль/кг
Г Сm (NaCl) = 0,01 моль/кг
15 Для какого из водных растворов температура кипения будет наибольшей:
А Сm (NaNO3) = 0,01 моль/кг
Б Сm (NaClO4) = 0,01 моль/кг
В Сm (Na2SO4) = 0,01 моль/кг
Г Сm (AlCl3) = 0,01 моль/кг
16 Какой из растворов хлорида натрия будет гипотоническим по отношению к крови:
А ω (NaCl) = 0,009
Б ω (NaCl) = 0,9
В ω (NaCl) = 0,00009
Г ω (NaCl) = 0,09
17 Какой из растворов хлорида натрия будет гипертоническим по отношению к крови:
А ω (NaCl) = 0,009
Б ω (NaCl) = 0,0009
В ω (NaCl) = 0,00009
Г ω (NaCl) = 0,09
18 Какой из растворов при to 37oC имеет меньшее осмотическое давление:
А С (СaCl2 ) = 0,1 моль/л
Б С (LiNO3) = 0,1 моль/л
В С (глюкозы) = 0,1 моль/л
Г С (K2SO4) = 0,1 моль/л
19 Какое осмотическое давление должны иметь растворы, которые используются в медицинской практике как изотонические растворы или кровезаменители:
А 500-600 кПа
Б 740-800 кПа
В 800-900 кПа
Г 400-500 кПа
20 Чему будет равняться изотонический коэффициент Вант-Гоффа для хлорида кальция, если это вещество полностью продиссоциировало в водном растворе:
А i = 1
Б i = 2
В i = 3
Г i = 4
21 Чему будет равняться изотонический коэффициент Вант-Гоффа для хлорида калия, если это вещество полностью продиссоциировало в водном растворе:
А i = 1
Б i = 2
В i = 3
Г i = 4
22 Осмотическое давление раствора можно рассчитать пользуясь:
А Законом Вант-Гоффа
Б 1-м законом Рауля
В 2-м законом Рауля
Г Законом Генри
23 Изменение температуры кипения раствора можно рассчитать пользуясь:
А Законом Вант-Гоффа
Б 1-м законом Рауля
В 2-м законом Рауля
Г Законом Генри
24 Изменение давления пара над раствором можно рассчитать пользуясь:
А Законом Вант-Гоффа
Б 1-м законом Рауля
В 2-м законом Рауля
Г Законом Генри
25 Чему будет равняться изотонический коэффициент Вант-Гоффа для сульфида калия, если это вещество полностью продиссоциировало в водном растворе:
А i = 1
Б i = 2
В i = 3
Г i = 4
Источник
Осмос. Осмотическое давление. Закон Вант-Гоффа для растворов неэлектролитов
Часть I. Теория. Общая химия
Растворы и их значение в процессах жизнедеятельности
1. Коллигативные свойства разбавленных растворов неэлектролитов. Закон Рауля: формулировки, расчетные формулы.
Неэлектролиты — вещества, водные растворы и расплавы которых не проводят электрический ток, так как их молекулы не диссоциируют на ионы. К неэлектролитам относятся спирты, углеводы и т.д. Вразбавленном растворе неэлектролита число частиц совпадает с числом молекул. При этом молекулы растворенного вещества практически не взаимодействуют друг с другом из-за большого расстояния между ними. Поведение этих молекул в растворе аналогично поведению молекул идеального газа.Разбавленные растворы неэлектролитов, как идеальных разбавленных растворов обладают рядом свойств ( коллигативные свойства), количественное выражение которых зависит только от числа находящихся в растворе частиц растворенного вещества и от количества растворителя.
К коллигативным свойствам растворов относят:
1) понижение давления насыщенного пара растворителя над раствором,
2) понижение температуры замерзания и повышение температуры кипения растворов по сравнению с температурами замерзания и кипения чистых растворителей.
3) осмотическое давление.
Закон Рауляописывает зависимость между давлением насыщенного пара растворителя над раствором и концентрацией растворенного вещества.Насыщеннымназывают пар, находящийся в равновесии с жидкостью. Давление такого пара над чистым растворителем (p) называют давлением или упругостью насыщенного пара чистого растворителя.
В 1886 (1887) году Ф. М. Рауль сформулировал закон:
относительное понижение давления насыщенного пара растворителя над раствором нелетучего вещества равно его молярной доле:
, где
Ро – давление насыщенного пара растворителя над растворителем, Р – давление насыщенного пара растворителя над раствором, N – молярная доля растворенного вещества, n – количество растворенного вещества,nо – количество вещества растворителя
2. Следствие из закона Рауля: понижение температуры замерзания растворов, повышение температуры кипения растворов.
Понижение температуры замерзания и повышение температуры кипения растворов по сравнению с таковыми для чистого растворителя пропорциональны моляльной концентрации растворенного вещества:
,
где Δtкип – повышение температуры кипения раствора, °С;
Δtзам – понижение температуры замерзания раствора, °С;
Кэ – эбуллиоскопическая константы растворителя, (кг×°С)/моль; Кэ (Н2О) = 0,52 кг∙К∙моль -1
Кк – криоскопическая константы растворителя, (кг×°С)/моль; Кк (Н2О) = 1,86 кг∙К∙моль -1
b – моляльная концентрация, моль/кг;
ν(раств. в-ва) – количество растворенного вещества, моль;
m(р-ля) – масса растворителя, кг;
m(раств. в-ва) – масса растворенного вещества, г;
М(раств. в-ва) – молярная масса растворенного вещества, г/моль.
Зная температуры кипения и замерзания чистых растворителей и Δt можно рассчитать температуры кипения и замерзания растворов:
tкип.(р-ра) = tкип.(р-ля) + Δtкип. tзам.(р-ра) = tзам.(р-ля) – Δtзам.
Осмос. Осмотическое давление. Закон Вант-Гоффа для растворов неэлектролитов.
Осмосом называется одностороннее проникновение молекул растворителя (диффузия) через полупроницаемую мембрану из растворителя в раствор или из раствора с меньшей концентрацией в раствор с большей концентрацией. осмос – самопроизвольный процесс.
Пример: Если в закрытый стеклянный сосуд поместить стакан с чистым растворителем и стакан с раствором какого-либо нелетучего вещества (уровни жидкостей в сосудах одинаковы), то через некоторое время уровень жидкости в первом стакане понизится, а уровень раствора во втором стакане повысится. В этом случае происходит переход растворителя из первого стакана во второй стакан, что обусловлено (по закону Рауля) более низким давлением пара рас–творителя над раствором, чем над чистым раствори–телем. При этом воздушное пространство между растворителем и раствором выполняет роль полупроницаемой мембраны.
Осмотическое давление – сила, обуславливающая осмос. Оно равно внешнему давлению, при котором осмос видимо прекращается.
Закон Вант-Гоффа. Осмотическое давление раствора равно газовому давлению, которое производило бы растворенное вещество, находясь в газообразном состоянии и занимая объем, равный объему раствора. Осмотическое давление раствора прямо пропорционально молярной концентрации растворенного вещества.
,
где Росм – осмотическое давление, кПа;
с – молярная концентрация растворенного вещества, моль/л;
R – универсальная газовая постоянная, 8,314 Дж/(моль×К);
Т – абсолютная температура, К;
V(р-ра) – объем раствора, л.
Дата добавления: 2018-02-28 ; просмотров: 7643 ;
Источник
Осмотическое давление
Изучение свойств разбавленных растворов показало, что между газообразным состоянием вещества и состоянием его в растворах существует большое сходство.
Как молекулы газа вследствие своего движения занимают наибольший объем, оказывая при этом давление на стенки сосуда, в котором газ заключен, так и молекулы растворенного вещества стремятся занять наибольший объем. Объем газа определяется размерами сосуда, а объем, в котором могут распределяться молекулы растворенного вещества, — объемом, занимаемым раствором. Если поместить в цилиндр концентрированный раствор какого-нибудь вещества, например раствор сахара, а поверх него осторожно налить слой чистой воды, то постепенно молекулы сахара равномерно распределятся по всему объему жидкости. Это явление, как известно, называется диффузией; диффузия продолжается до тех пор, пока концентрация молекул сахара не станет одинаковой во всех слоях жидкости.
Рис. 68. Прибор для демонстрации осмотического давления раствора
Равномерное распределение молекул сахара и воды во всем объеме жидкости может происходить двумя путями: или молекулы сахара, оставляя нижний слой воды, переходят в верхний, пока их концентрация в обоих слоях не сравняется, или молекулы воды проникают из верхнего слоя в нижний, пока не перемешаются равномерно с молекулами сахара. Окончательный результат, очевидно, в обоих случаях будет один и тот же. В действительности выравнивание концентрации идет обоими путями, т. е. происходит как движение молекул сахара в воду, так и движение молекул воды в раствор сахара.
Представим теперь, что вода и раствор сахара разделены пористой перегородкой, через которую могут свободно проходить молекулы воды, но не могут проникать молекулы сахара. Подобного рода «полупроницаемая» перегородка может быть получена, например, пропиткой глиняного пористого цилиндра раствором медного купороса с последующим погружением цилиндра в раствор железистосинеродистого калия. В результате такой обработки в порах цилиндра оседает железистосинеродистая медь и стенки цилиндра становятся полупроницаемыми.
Если в обработанный таким образом цилиндр налить раствор сахара и погрузить цилиндр в чистую воду, то выравнивание кон центраций (или, вернее, уменьшение концентрации раствора сахара) будет происходить только вследствие перемещения молекул воды. Последние в большем числе диффундируют в раствор, чем обратно; поэтому объем раствора будет постепенно увеличиваться, а концентрация сахара в нем уменьшаться. Такая односторонняя диффузия через полупроницаемую перегородку называется осмосом. При достаточном количестве воды переход ее в раствор через полупроницаемую перегородку, строго говоря, должен продолжаться бесконечно, если этому не воспрепятствует какая-нибудь сила, действующая в противоположном направлении.
Возьмем сосуд с полупроницаемыми стенками, переходящий вверху в длинную узкую вертикальную трубку (рис. 68). Наполним его раствором сахара и погрузим в сосуд с чистым растворителем. Вследствие осмоса объем раствора будет постепенно увеличиваться и раствор начнет заполнять вертикальную трубку. По мере поднятия уровня раствора в трубке будет создаваться избыточное гидростатическое давление, измеряемое разностью уровней раствора и растворителя и противодействующее проникновению молекул растворителя в раствор. Когда гидростатическое давление достигнет определенной величины, осмос прекратится. Сила, обусловливающая осмос, называется осмотическим давлением раствора. Величина осмотического давления определяется тем внешним давлением на раствор, при котором осмос прекращается .
Явления осмоса играют очень важную роль в жизни животных и особенно растительных организмов. Оболочки клеток представляют собой перепонки, легко проницаемые для воды, но почти непроницаемые для веществ, растворенных в клеточном соке. Проникая в клетки, вода создает в них довольно большое давление, которое слегка растягивает оболочки клеток и поддерживает их в напряженном состоянии. Вот почему такие мягкие органы растения, как травянистые стебли, листья, лепестки цветов, обладают известной упругостью. Если срезать растение, то вследствие испарения воды через оболочки клеток объем клеточного сока уменьшается, оболочки клеток опадают, становятся дряблыми — растение вянет. Но стоит только начавшее вянуть растение поставить в воду, как начинается осмос, оболочки клеток снова напрягаются и растение принимает прежний вид.
Осмос является также одной из причин, обусловливающих поднятие воды по стеблю растения, рост клеток и многие другие явления.
Первые точные измерения величины осмотического давления, прозеденные Пфейфером, привели к установлению двух следую щих положении:
1. Осмотическое давление раствора прямо пропорционально концентрации растворенного вещества.
2. Осмотическое давление пропорционально абсолютной температуре раствора.
В 1886 г. голландский физико-химик Вант-Гофф впервые обратил внимание на полную аналогию между этими положениями и газовыми законами Бойля-Мариотта и Гей-Люссака. Использовав числовые данные, полученные при измерениях осмотического давления, он показал, что величина осмотического давления для разбавленных растворов может быть выражена уравнением, совершенно сходным с уравнением состояния газа
где Р — осмотическое давление, а V — объем раствора, содержащего 1 граммолекулу растворенного вещества. При этом оказывается, что постоянная R имеет то же самое числовое значение, что и в уравнении газового состояния
Отсюда следует, что закон Авогадро также применим к разбавленным растворам. И действительно, опыт показывает, что эквимолекулярнрые (т. е. содержащие одно и то же число молекул в 1 л) растворы различных веществ при одинаковой температуре обладают и одинаковым осмотическим давлением. В частности, растворы, содержащие 1 граммолекулу растворенного вещества в 22,4 л, обладают при 0° осмотическим давлением, равным 1 ат.
Растворы, имеющие одинаковое осмотическое давление, называются изотоническими.
Таким образом осмотическое давление, подобно давлению газа, при неизменном объеме и постоянной температуре зависит только от числа молекул растворенного вещества, но не зависит ни от природы растворенного вещества, ни от природы растворителя.
Если заменить в предыдущем уравнении молекулярный объем V концентрацией С, выраженной в молях на 1 л (V =1/С), то получим более удобное для вычисления осмотического давления выражение:
Глубокая аналогия между газами и растворами ясно выражена в следующем положении, носящем название закона Вант-Гоффа:
Осмотическое давление раствора равно тому давлению, которое производило бы растворенное вещество, если бы оно при той же температуре находилось в газообразном состоянии и занимало объем, равный объему раствора.
Этим законом и выражается сущность теории растворов Вант-Гоффа. Необходимо, однако, подчеркнуть, что, несмотря на полную аналогию числовых зависимостей, механизмы газового и осмотического давлений совершенно различны.
Яков Генрих Вант-Гофф (Jacobus Henricus Van’t Hoff) — один из основоположников современной физической химии, родился в г. Роттердаме (Голландия) 30 августа 1852 г. Окончив техническое училище в Дельфте, он изучал затем химию в университетах Бонна, Парижа и Утрехта. В 1874 г. получил степень доктора математики и натуральной философии в Утрехтском университете.
С 1896 г. и до конца своей жизни Вант-Гофф занимался солевыми равновесиями в растворах.
Вант-Гофф состоял членом-корреспондентом Петербургской Академии наук и с 1898 г. почетным членом Московского Общества испытателей природы.
Закон Вант-Гоффа справедлив только для разбавленных растворов. В концентрированных растворах наблюдаются значительные отклонения от него. Еще большие отклонения^ обнаруживаются в водных растворах электролитов — веществ, проводящих ток в водном растворе, о чем подробно будет сказано в следующей главе.
Яков Генрих Вант-Гофф (1852—1911)
Благодаря зависимости между молярной концентрацией раствора и его осмотическим давлением можно по величине осмотического давления вычислять молекулярные веса многих веществ, которые не превращаются в газообразное состояние, но легко растворяются в том или ином растворителе. Наоборот, зная молярную концентрацию раствора, можно рассчитать его осмотическое давление. При расчетах полезно иметь в виду, что осмотическое давление раствора, содержащего в литре 1 моль растворенного вещества, может быть принято равным 22,4 ат (хотя фактически при такой концентрации раствора оно несколько больше).
Пример. Рассчитать осмотическое давление раствора, содержащего в литре 9 г глюкозы.
Молекулярный вес глюкозы 180; следовательно, 9 г составляют 0,05 моля. Так как осмотическое давление пропорционально количеству растворенного вещества, то искомое осмотическое давление (х) находим из пропорции:
Непосредственное измерение осмотического давления представляет довольно большие трудности, но в этом и нет настоятельной необходимости. Как показал Вант-Гофф, осмотическое давление тесно связано с некоторыми другими свойствами разбавленных растворов, сравнительно легко поддающимися измерению, а именно: с понижением давления пара, понижением температуры замерзания, повышением температуры кипения. Определив любую из этих величин, можно по ней рассчитать и осмотическое давление раствора. Так как все эти величины, подобно осмотическому давлению, изменяются пропорционально числу частиц растворенного вещества, то они также могут быть использованы для определения молекулярного веса растворенных веществ.
Вы читаете, статья на тему Осмотическое давление
Источник
➤ Adblock
detector
Источник