Какое давление является параметром состояния идеального газа
Содержание статьи
Идеальный газ. Параметры состояния идеального газа
ОПРЕДЕЛЕНИЕ: Идеальным газом называется газ, при рассмотрении свойств которого соблюдаются следующие условия:
а) соударения молекул такого газа происходят как соударения упругих шаров, размеры которых пренебрежимо малы;
б) от столкновения до столкновения молекулы движутся равномерно и прямолинейно;
в) пренебрегают силами взаимодействия между молекулами.
Реальные газы при комнатной температуре и нормальном давлении ведут себя как идеальные газы. Идеальными газами можно считать такие газы как гелий, водород, свойства которых уже при обычных условиях отвечают закономерностям идеального газа.
Состояние некоторой массы идеального газа будет определяться значениями трех параметров: P, V, T. Эти величины, характеризующие состояние газа, называются параметрами состояния. Эти параметры закономерно связаны друг с другом, так что изменение одного из них влечет за собой изменение другого. Эта связь аналитически может быть задана в виде функции:
Соотношение, дающее связь между параметрами какого-либо тела, называется уравнением состояния. Следовательно, данное соотношение является уравнением состояния идеального газа.
Рассмотрим некоторые из параметров состояния, характеризующих состояние газа:
1) Давление (P). В газе давление возникает в результате хаотического движения молекул, в результате которого молекулы сталкиваются друг с другом и со стенками сосуда. В результате удара молекул о стенку сосуда со стороны молекул на стенку будет действовать некоторая средняя сила dF. Предположим, что площадь поверхности dS, тогда . Следовательно:
ОПРЕДЕЛЕНИЕ (механистическое): Давление – это физическая величина, численно равная силе, действующей на единицу площади поверхности, нормальную к ней.
Если сила равномерно распределена по поверхности, то . В системе СИ давление измеряется в 1Па=1Н/м2.
2) Температура (Т).
ОПРЕДЕЛЕНИЕ (предварительное): Температура тела – это термодинамическая величина, характеризующая состояние термодинамического равновесия макроскопической системы.
Температура одинакова для всех частей изолированной системы, находящейся в состоянии термодинамического равновесия. Т.е., если соприкасающиеся тела находятся в состоянии теплового равновесия, т.е. не обмениваются энергией путем теплопередачи, то этим телам приписывается одинаковая температура. Если при установлении теплового контакта между телами одно из них передает энергию другому посредством теплопередачи, то первому телу приписывается большая температура, чем второму.
Любое из свойств тела (температурный признак), зависящее от температуры может быть использовано для количественного определения (измерения) температуры.
Например: если в качестве температурного признака выбрать объем и считать, что с температурой объем изменяется линейно, то выбрав за “0” температуру таяния льда, а за 100° – температуру кипения воды, получим температурную шкалу, называемую шкалой Цельсия. Согласно которой состоянию, в котором термодинамическое тело имеет объем V, следует приписывать температуру:
Для однозначного определения температурной шкалы необходимо условиться, кроме способа градуировки, также о выборе термометрического тела (т.е. тела, которое выбирается для измерения) и температурного признака.
Известны две температурные шкалы:
1) t – эмпирическая или практическая шкала температур (°C). (О выборе термометрического тела и температурного признака для этой шкалы скажем позже).
2) T – термодинамическая или абсолютная шкала (°K). Эта шкала не зависит от свойств термодинамического тела (но об этом речь пойдет позже).
Температура T, отсчитанная по абсолютной шкале, связана с температурой t по практической шкале соотношением
T = t + 273,15.
Единицу абсолютной температуры называют Кельвином. Температуру по практической шкале измеряют в град. Цельсия (°C). Значения град. Кельвина и град. Цельсия одинаковы. Температура равная 0°K называется абсолютным нулем, ему соответствует t=-273,15°C

Источник
ИНФОФИЗ — мой мир…
Как известно, многие вещества в природе могут находиться в трех агрегатных состояниях: твердом, жидком и газообразном.
Учение о свойствах вещества в различных агрегатных состояниях основывается на представлениях об атомно-молекулярном строении материального мира. В основе молекулярно-кинетической теории строения вещества (МКТ) лежат три основных положения:
- все вещества состоят из мельчайших частиц (молекул, атомов, элементарных частиц), между которыми есть промежутки;
- частицы находятся в непрерывном тепловом движении;
- между частицами вещества существуют силы взаимодействия (притяжения и отталкивания); природа этих сил электромагнитная.
Значит, агрегатное состояние вещества зависит от взаимного расположения молекул, расстояния между ними, сил взаимодействия между ними и характера их движения.
Сильнее всего проявляется взаимодействие частиц вещества в твердом состоянии. Расстояние между молекулами примерно равно их собственным размерам. Это приводит к достаточно сильному взаимодействию, что практически лишает частицы возможности двигаться: они колеблются около некоторого положения равновесия. Они сохраняют форму и объем.
Свойства жидкостей также объясняются их строением. Частицы вещества в жидкостях взаимодействуют менее интенсивно, чем в твердых телах, и поэтому могут скачками менять свое местоположение – жидкости не сохраняют свою форму – они текучи. Жидкости сохраняют объем.
Газ представляет собой собрание молекул, беспорядочно движущихся по всем направлениям независимо друг от друга. Газы не имеют собственной формы, занимают весь предоставляемый им объем и легко сжимаются.
Существует еще одно состояние вещества – плазма. Плазма — частично или полностью ионизованный газ, в котором плотности положительных и отрицательных зарядов практически одинаковы. При достаточно сильном нагревании любое вещество испаряется, превращаясь в газ. Если увеличивать температуру и дальше, резко усилится процесс термической ионизации, т. е. молекулы газа начнут распадаться на составляющие их атомы, которые затем превращаются в ионы.
Модель идеального газа. Связь между давлением и средней кинетической энергией.
Для выяснения закономерностей, которым подчиняется поведение вещества в газообразном состоянии, рассматривается идеализированная модель реальных газов – идеальный газ. Это такой газ, молекулы которого рассматриваются как материальные точки, не взаимодействующие друг с другом на расстоянии, но взаимодействующие друг с другом и со стенками сосуда при столкновениях.
Идеальный газ – это газ, взаимодействие между молекулами которого пренебрежимо мало. (Ек>>Ер)
Идеальный газ – это модель, придуманная учеными для познания газов, которые мы наблюдаем в природе реально. Она может описывать не любой газ. Не применима, когда газ сильно сжат, когда газ переходит в жидкое состояние. Реальные газы ведут себя как идеальный, когда среднее расстояние между молекулами во много раз больше их размеров, т.е. при достаточно больших разрежениях.
Свойства идеального газа:
- расстояние между молекулами много больше размеров молекул;
- молекулы газа очень малы и представляют собой упругие шары;
- силы притяжения стремятся к нулю;
- взаимодействия между молекулами газа происходят только при соударениях, а соударения считаются абсолютно упругими;
- молекулы этого газа двигаются беспорядочно;
- движение молекул по законам Ньютона.
Состояние некоторой массы газообразного вещества характеризуют зависимыми друг от друга физическими величинами, называемыми параметрами состояния. К ним относятся объем V, давление p и температура T.
Объем газа обозначается V. Объем газа всегда совпадает с объемом того сосуда, который он занимает. Единица объема в СИ м3.
Давление – физическая величина, равная отношению силы F, действующей на элемент поверхности перпендикулярно к ней, к площади S этого элемента.
p = F/S Единица давления в СИ паскаль [Па]
До настоящего времени употребляются внесистемные единицы давления:
техническая атмосфера 1 ат = 9,81-104 Па;
физическая атмосфера 1 атм = 1,013-105 Па;
миллиметры ртутного столба 1 мм рт. ст.= 133 Па;
1 атм = = 760 мм рт. ст. = 1013 гПа.
Как возникает давление газа? Каждая молекула газа, ударяясь о стенку сосуда, в котором она находится, в течение малого промежутка времени действует на стенку с определенной силой. В результате беспорядочных ударов о стенку сила со стороны всех молекул на единицу площади стенки быстро меняется со временем относительно некоторой (средней) величины.
Давление газа возникает в результате беспорядочных ударов молекул о стенки сосуда, в котором находится газ.
Используя модель идеального газа, можно вычислить давление газа на стенку сосуда.
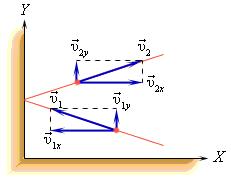
В процессе взаимодействия молекулы со стенкой сосуда между ними возникают силы, подчиняющиеся третьему закону Ньютона. В результате проекция υx скорости молекулы, перпендикулярная стенке, изменяет свой знак на противоположный, а проекция υy скорости, параллельная стенке, остается неизменной.
Приборы, измеряющие давление, называют манометрами. Манометры фиксируют среднюю по времени силу давления, приходящуюся на единицу площади его чувствительного элемента (мембраны) или другого приемника давления.
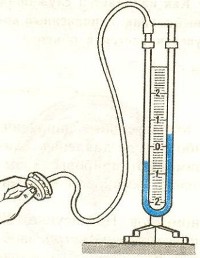
Жидкостные манометры:
- открытый – для измерения небольших давлений выше атмосферного
- закрытый — для измерения небольших давлений ниже атмосферного, т.е. небольшого вакуума

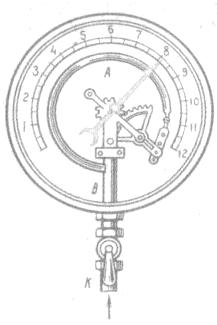
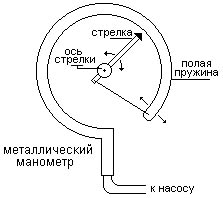
Металлический манометр – для измерения больших давлений.
Основной его частью является изогнутая трубка А, открытый конец которой припаян к трубке В, через которую поступает газ, а закрытый – соединен со стрелкой. Газ поступает через кран и трубку В в трубку А и разгибает её. Свободный конец трубки, перемещаясь, приводит в движение передающий механизм и стрелку. Шкала градуирована в единицах давления.
Основное уравнение молекулярно-кинетической теории идеального газа.
Основное уравнение МКТ: давление идеального газа пропорционально произведению массы молекулы, концентрации молекул и среднему квадрату скорости движения молекул
p = 1/3·m0·n·v2
m0 — масса одной молекулы газа;
n = N/V – число молекул в единице объема, или концентрация молекул;
v2 — средняя квадратичная скорость движения молекул.
Так как средняя кинетическая энергия поступательного движения молекул E = m0*v2/2, то домножив основное уравнение МКТ на 2, получим p = 2/3· n·(m0· v2)/2 = 2/3·E·n
p = 2/3·E·n
Давление газа равно 2/3 от средней кинетической энергии поступательного движения молекул, которые содержатся в единичном объеме газа.
Так как m0·n = m0·N/V = m/V = ρ, где ρ – плотность газа, то имеем p = 1/3· ρ· v2
Объединенный газовый закон.
Макроскопические величины, однозначно характеризующие состояние газа, называют термодинамическими параметрами газа.
Важнейшими термодинамическими параметрами газа являются его объем V, давление р и температура Т.
Всякое изменение состояния газа называется термодинамическим процессом.
В любом термодинамическом процессе изменяются параметры газа, определяющие его состояние.
Соотношение между значениями тех или иных параметров в начале и конце процесса называется газовым законом.
Газовый закон, выражающий связь между всеми тремя параметрами газа называется объединенным газовым законом.
p = nkT
Соотношение p = nkT связывающее давление газа с его температурой и концентрацией молекул, получено для модели идеального газа, молекулы которого взаимодействуют между собой и со стенками сосуда только во время упругих столкновений. Это соотношение может быть записано в другой форме, устанавливающей связь между макроскопическими параметрами газа – объемом V, давлением p, температурой T и количеством вещества ν. Для этого нужно использовать равенства
где n – концентрация молекул, N – общее число молекул, V – объем газа
Тогда получим или
Так как при постоянной массе газа N остается неизменным, то Nk – постоянное число, значит
При постоянной массе газа произведение объема на давление, деленное на абсолютную температуру газа, есть величина одинаковая для всех состояний этой массы газа.
Уравнение, устанавливающее связь между давлением, объемом и температурой газа было получено в середине XIX века французским физиком Б. Клапейроном и часто его называют уравнением Клайперона.
Уравнение Клайперона можно записать в другой форме.
p = nkT,
учитывая, что
Здесь N – число молекул в сосуде, ν – количество вещества, NА – постоянная Авогадро, m – масса газа в сосуде, M – молярная масса газа. В итоге получим:
Произведение постоянной Авогадро NА на постоянную Больцмана k называется универсальной (молярной) газовой постоянной и обозначается буквой R.
Ее численное значение в СИ R = 8,31 Дж/моль·К
Соотношение
называется уравнением состояния идеального газа.
В полученной нами форме оно было впервые записано Д. И. Менделеевым. Поэтому уравнение состояния газа называется уравнением Клапейрона–Менделеева.`
Для одного моля любого газа это соотношение принимает вид: pV=RT
Установим физический смысл молярной газовой постоянной. Предположим, что в некотором цилиндре под поршнем при температуре Е находится 1 моль газа, объем которого V. Если нагреть газ изобарно (при постоянном давлении) на 1 К, то поршень поднимется на высоту Δh, а обьем газа увеличится на ΔV.
Запишем уравнение pV=RT для нагретого газа: p ( V + ΔV ) = R (T + 1)
и вычтем из этого равенства уравнение pV=RT , соответствующее состоянию газа до нагревания. Получим pΔV = R
ΔV = SΔh, где S – площадь основания цилиндра. Подставим в полученное уравнение:
pSΔh = R
pS = F – сила давления.
Получим FΔh = R, а произведение силы на перемещение поршня FΔh = А – работа по перемещению поршня, совершаемая этой силой против внешних сил при расширении газа.
Таким образом, R = A.
Универсальная (молярная) газовая постоянная численно равна работе, которую совершает 1 моль газа при изобарном нагревании его на 1 К.
Источник
Какое давление является параметром состояния идеального газа
Идеальный газ. Параметры состояния газа
Основные понятия идеального газа
Реальные газы хорошо описываются моделью идеального газа при достаточно больших разрежениях, т.е. когда среднее расстояние между молекулами газа во много раз больше размеров самих молекул. В этом случае силами притяжения между молекулами можно пренебречь, а силы отталкивания проявляются только при столкновениях молекул друг с другом в течение очень коротких промежутков времени. например, водород, кислород при нормальных условиях хорошо описываются моделью идеального газа.
Под нормальными условиями понимают состояние газа при температуре T=273 K и давлении p=101325 Па.
Состояние газов, удовлетворяющих модели идеального газа, описывается более простыми уравнениями, чем в случае реальных газов, в уравнениях для которых возникают многочисленные поправки, учитывающие взаимодействие между молекулами и их суммарный собственный объем. По сути, в модели идеального газа молекулы представляются в виде маленьких упругих шариков, которые, не задевая друг друга, летают по всему предоставленному объему и, изменяя свой импульс при ударах о стенки, оказывают на них давление.
Параметры состояния газа. Макро- и микропараметры
Состояние любой термодинамической системы описывается ее макро- и микропараметрами.
Основными макропараметрами или параметрами состояния идеального газа являются давление, температура и объем.
Давление характеризует силу ударов молекул газа о стенки сосуда. Температура является мерой кинетической энергии поступательного движения молекул газа. Объем – это область пространства, занимаемая газом.
К микропараметрам относятся масса молекулы, ее скорость, импульс, кинетическая энергия.
Состояние термодинамической системы, когда все ее параметры при неизменных внешних условиях не изменяются со временем, называютравновесным.
Примеры решения задач
| Задание | Учитель записал на доске три утверждения, относящиеся к молекулам: |
1) размерами молекул можно пренебречь;
2) молекулы при столкновениях взаимодействуют как упругие шары;
3) при любом расстоянии между молекулами между ними действуют силы притяжения.
Какие из этих утверждений можно соотнести с моделью идеального газа?
а) все три утверждения;
б) только первое утверждение;
в) первое и второе утверждения;
г) первое и третье утверждения.
а) молекулы сталкиваются как упругие шарики;
б) размеры молекул пренебрежимо малы;
в) молекулы взаимодействуют с силами притяжения и отталкивания;
г) молекулы сталкиваются со стенками абсолютно упругими ударами.
а) при температурах, близких к абсолютному нулю;
Источник
Идеальный газ. Параметры состояния идеального газа.
ОПРЕДЕЛЕНИЕ: Идеальным газом называется газ, при рассмотрении свойств которого соблюдаются следующие условия:
а) соударения молекул такого газа происходят как соударения упругих шаров, размеры которых пренебрежимо малы;
б) от столкновения до столкновения молекулы движутся равномерно и прямолинейно;
в) пренебрегают силами взаимодействия между молекулами.
Реальные газы при комнатной температуре и нормальном давлении ведут себя как идеальные газы. Идеальными газами можно считать такие газы как гелий, водород, свойства которых уже при обычных условиях отвечают закономерностям идеального газа.
Состояние некоторой массы идеального газа будет определяться значениями трех параметров: P, V, T. Эти величины, характеризующие состояние газа, называются параметрами состояния. Эти параметры закономерно связаны друг с другом, так что изменение одного из них влечет за собой изменение другого. Эта связь аналитически может быть задана в виде функции:
Соотношение, дающее связь между параметрами какого-либо тела, называется уравнением состояния. Следовательно, данное соотношение является уравнением состояния идеального газа.
Рассмотрим некоторые из параметров состояния, характеризующих состояние газа:
1) Давление (P). В газе давление возникает в результате хаотического движения молекул, в результате которого молекулы сталкиваются друг с другом и со стенками сосуда. В результате удара молекул о стенку сосуда со стороны молекул на стенку будет действовать некоторая средняя сила dF. Предположим, что площадь поверхности dS, тогда
. Следовательно:
ОПРЕДЕЛЕНИЕ (механистическое): Давление – это физическая величина, численно равная силе, действующей на единицу площади поверхности, нормальную к ней.
Если сила равномерно распределена по поверхности, то
. В системе СИ давление измеряется в 1Па=1Н/м 2 .
ОПРЕДЕЛЕНИЕ (предварительное): Температура тела – это термодинамическая величина, характеризующая состояние термодинамического равновесия макроскопической системы.
Температура одинакова для всех частей изолированной системы, находящейся в состоянии термодинамического равновесия. Т.е., если соприкасающиеся тела находятся в состоянии теплового равновесия, т.е. не обмениваются энергией путем теплопередачи, то этим телам приписывается одинаковая температура. Если при установлении теплового контакта между телами одно из них передает энергию другому посредством теплопередачи, то первому телу приписывается большая температура, чем второму.
Любое из свойств тела (температурный признак), зависящее от температуры может быть использовано для количественного определения (измерения) температуры.
Например: если в качестве температурного признака выбрать объем и считать, что с температурой объем изменяется линейно, то выбрав за “0” температуру таяния льда, а за 100° – температуру кипения воды, получим температурную шкалу, называемую шкалой Цельсия. Согласно которой состоянию, в котором термодинамическое тело имеет объем V, следует приписывать температуру:
Для однозначного определения температурной шкалы необходимо условиться, кроме способа градуировки, также о выборе термометрического тела (т.е. тела, которое выбирается для измерения) и температурного признака.
Известны две температурные шкалы:
1) t – эмпирическая или практическая шкала температур (°C). (О выборе термометрического тела и температурного признака для этой шкалы скажем позже).
2) T – термодинамическая или абсолютная шкала (°K). Эта шкала не зависит от свойств термодинамического тела (но об этом речь пойдет позже).
Температура T, отсчитанная по абсолютной шкале, связана с температурой t по практической шкале соотношением
Единицу абсолютной температуры называют Кельвином. Температуру по практической шкале измеряют в град. Цельсия (°C). Значения град. Кельвина и град. Цельсия одинаковы. Температура равная 0°K называется абсолютным нулем, ему соответствует t=-273,15°C
Газовые законы.
Если разрешить уравнение состояния идеального газа
относительно какого-либо из параметров, например, p, то уравнение состояния примет вид
.
И известные из школьного курса физики законы Бойля-Мариотта и Гей-Люссака дают уравнения состояния для случаев, когда один параметров остается постоянным.
Известные газовые законы (Бойля-Мариотта, Гей-Люссака, Дальтона, Авогадро) были открыты опытным путем задолго до появления молекулярно-кинетической теории. Эти законы были установлены на опытах с газами, находящимися в условиях, не очень сильно отличающихся от нормальных атмосферных условий, т.е. при не очень низких температурах и не очень высоких давлениях. При иных условиях экспериментальные газовые законы уже не точно отражают свойства газов, т.е. все эти законы являются приближенными.
Рассмотрим некоторые из этих законов:
1) Закон Бойля—Мариотта (m = const, T = const).
Изучая изотермические процессы, английский ученый Бойль (1662г.) и французский ученый Мариотт (1667г.) независимо друг от друга установили следующий закон:
ОПРЕДЕЛЕНИЕ: Для данной массы газа при постоянной температуре (T = const) давление газа изменяется обратно пропорционально объему.
Аналитически это можно записать в виде: P·V = const (T = const). Совокупность состояний, отвечающих одной и той же температуре, изобразится на диаграмме (P, V) кривой, определяемой уравнением гиперболы. Каждому значению температуры соответствует своя кривая, называемая изотермой. А переход газа из одного состояния в другой, совершающийся при постоянной температуре, называется изотермическим процессом.
2) Закон Гей-Люссака (m = const, P = const).
Изучая изобарические газовые процессы, французский физик Гей-Люссак в 1802г. установил следующий закон:
ОПРЕДЕЛЕНИЕ: Для данной массы газа при постоянном давлении объем газа меняется линейно с ростом температуры:
,
где V – объем газа при температуре t°;
V – объем газа при 0°C;
a – термический коэффициент объемного расширения ( ). Термический коэффициент объемного расширения показывает, на какую часть относительно первоначального объема изменится объем газа при его нагреве на 1°. Для большинства газов .
Процесс, протекающий при постоянном давлении, называется изобарическим. Для газа такой процесс отобразится на диаграмме (V, t°) прямой; здесь различные прямые отвечают разным давлениям и называются изобарами.
3) Закон Шарля (m = const, V = const).
ОПРЕДЕЛЕНИЕ: Для данной массы газа при постоянном объеме давление газа изменяется линейно с ростом температуры:
,
где P – давление газа при температуре t°;
P – давление газа при 0°C;
g – термический коэффициент давления газа ( ).
Аналогично сказанному ранее относительно коэффициента “a”, термический коэффициент давления газа показывает, на какую часть относительно первоначального давления изменится давление газа при его нагревании на 1°С.
Для идеального газа также . Для идеального газа .
Изохорический процесс, т.е. процесс, протекающий при постоянном объеме на диаграмме (P, t°) изобразится прямой линией. Различные прямые соответствую различным объемам и называются изохорами.
Заметим теперь, что все изобары и изохоры пересекают ось t° в одной и той же точке, определяемой из условия 1+a×t°=0. Откуда
.
Если за начало отсчета температуры взять нуль (как это и было), то получим шкалу температур по Цельсию. Если сместить начало отсчета в точку -273.15, то перейдем к другой температурной шкале, которая называется абсолютной (или шкалой Кельвина).
В соответствии с определением абсолютной шкалы между абсолютной температурой (Т) и температурой по Цельсию (t) существует следующее соотношение:
. (9.1)
Температура равная 0°К называется абсолютным нулем.
Для установления абсолютной шкалы температур и абсолютного нуля мы воспользовались законами Гей-Люссака и Шарля и поступили сугубо формально. Однако Кельвин в 1852г., исходя из иных физических соображений установил такую же абсолютную шкалу температур с тем же значением абсолютного нуля, какие ранее были получены формально. Поэтому понятия абсолютной температуры и абсолютного нуля не следует рассматривать как формальные, не имеющие физического смысла. Кельвин показал, что абсолютный нуль – это самая низкая из возможных температур вещества. При абсолютном нуле прекращается хаотическое движение молекул в веществе. Однако это не означает, что в нем прекращается всякое движение. Сохраняется, например, движение электронов в атоме. В настоящее время удается охлаждать малые объемы вещества до температуры очень близкой к абсолютному нулю, не достигая последнего лишь на несколько тысячных долей градуса.
Перейдем теперь в уравнениях, описывающих законы Гей-Люссака и Шарля от температуры по Цельсию к абсолютной температуре, подставив вместо t величину
. . (9.2) (при условии g=a).
Из этих уравнений следует, что
где индексы 1 и 2 относятся к произвольным состояниям, лежащим на одной и той же изобаре (для уравнения (9.3)), или одной и той же изохоре (для уравнения (9.4)).
Итак, при постоянном давлении объем газа пропорционален абсолютной температуре; и при постоянном объеме давление газа пропорционально абсолютной температуре.
Всякий реальный газ тем точнее следует уравнениям PV = const,
, , чем меньше его плотность, т.е., чем больший объем он занимает.
В соответствии с уравнением PV = const, объем растет с уменьшением давления, а согласно с
объем возрастает с температурой. Следовательно, рассмотренные газовые законы справедливы при не слишком низких температурах и невысоких давлениях.
Газ, который точно следует этим уравнениям, называется идеальным. Всякий реальный газ по мере убывания его плотности приближается к идеальному.
Замечание:
ОПРЕДЕЛЕНИЕ: Парциальным давлением газа, входящего в газовую смесь, называется то давление, которое имел бы этот газ, если бы все остальные газы были удалены из объема.
В 1801гю английский физик и химик Дальтон установил соотношение между давлением газовой смеси и парциальными давлениями входящих в нее газов.
ОПРЕДЕЛЕНИЕ: Давление газовой смеси равно сумме парциальных давлений входящих в нее газов.
Закон Авогадро.
На основании опытов с различными газами итальянский ученый Авогадро в 1811г. установил следующий закон:
ОПРЕДЕЛЕНИЕ: При одинаковых температуре и давлении киломоли любых газов занимают одинаковые объемы.
При нормальных условиях (t=0°C, P=1атм) объем киломоля любого газа составляет 22,4м 3 /кмоль.
9.2.4. Уравнение состояния идеального газа (уравнение Менделеева — Клапейрона).
До этого рассматривались газовые процессы, при которых один из параметров состояния газа оставался неизменным, а два других изменялись. Теперь рассмотрим общий случай, когда изменяются все три параметра состояния газа и получим уравнение, связывающее все эти параметры. Закон, описывающий такого рода процессы, был установлен в 1834г. Клапейроном (французский физик, с 183г. работал в Петербургском институте путей сообщения) путем объединения рассмотренных выше законов.
Пусть имеется некоторый газ массой “m”. На диаграмме (P, V) рассмотрим два его произвольных состояния, определяемых значениями параметров P1, V1, T1 и P2, V2, T2. Из состояния 1 в состояние 2 будем переводить газ двумя процессами:
1. изотермического расширения (1®1¢);
2. изохорического охлаждения (1¢®2).
Первый этап процесса описывается законом Бойля-Мариотта, поэтому
. (9.5)
Второй этап процесса описывается законом Гей-Люссака:
. (9.6)
Исключая из этих уравнений
, получим: . (9.7)
Поскольку состояния 1 и 2 были взяты совершенно произвольно, то можно утверждать, что для любого состояния:
| – уравнение Клапейрона |
где С – постоянная для данной массы газа величина.
Недостатком этого уравнения является то, что величина “C” различна для различных газов, Для устранения этого недостатка Менделеев в 1875г. несколько видоизменил закон Клапейрона, объединив его с законом Авогадро.
Запишем полученное уравнение для объема Vкм. одного 1 киломоля газа, обозначив постоянную буквой “R”:
.
Согласно закону Авогадро при одинаковых значениях P и T киломоли всех газов будут иметь одинаковые объемы Vкм. и, следовательно, постоянная “R” будет одинакова для всех газов.
Постоянная “R”называется универсальной газовой постоянной. Полученное уравнение
связывает параметры киломоля идеального газа и, следовательно, представляет уравнение состояния идеального газа.
Значение постоянной “R” можно вычислить:
.
От уравнения для 1кмоль легко перейти к уравнению для любой массы газа “m”, приняв во внимание, что при одинаковых давлениях и температуре “z” киломолей газа будут занимать в ”z” раз больший объем, чем 1 кмоль. (V=z×Vкм.).
С другой стороны отношение
, где m – масса газа, m – масса 1 кмоля, будет определять число молей газа.
Умножим обе части уравнения Клапейрона на величину
, получим Þ (9.7а)
Это и есть уравнение состояния идеального газа, записанное для любой массы газа.
Уравнению
можно придать другой вид. Для этого введем величину ,
где R – универсальная газовая постоянная;
k – постоянная Больцмана (далее будет показано, что “k” представляет коэффициент пропорциональности между средней энергией теплового движения молекулы и абсолютной температурой).
Подстановка числовых значений R и NA дает следующее значение:
.
Умножим и разделим правую часть уравнения
на NA, тогда , здесь – число молекул в массе газа “m”. (*)
Вводя величину
– число молекул в единице объема, приходим к формуле: (**)
Уравнения (*) и (**) представляют различные формы записи уравнения состояния идеального газа.
Отношение
, тогда плотность идеального газа можно получить из уравнения . Þ Þ .
Таким образом, плотность идеального газа пропорциональна давлению и обратно пропорциональна температуре.
Простая связь между температурой и остальными параметрами идеального газа делает заманчивым его использование в качестве термометрического вещества. Обеспечив постоянство объема и использовав в качестве температурного признака давление газа, можно получить термометр с идеальной линейной температурной шкалой. Эту шкалу будем называть идеальной газовой шкалой температур.
Практически, по международному соглашению, в качестве термометрического тела берут водород. Установленная по водороду с использованием уравнения состояния идеального газа шкала называется эмпирической шкалой температур.
Последнее изменение этой страницы: 2016-12-11; Нарушение авторского права страницы
Источник
Источник