Какое давление газа называется парциальным
Содержание статьи
Парциальное давление
Прибор Рамзая для обнаружения парциального давления.
Во внутреннем сосуде Р из палладия находится смесь азота и водорода под общим давлением в 1 атм. Сосуд Р соединён с дифференциальным манометром и помещён в сосуд большего размера. При высоких температурах водород легко диффундирует через палладиевую оболочку, и стенки сосуда Р становятся полупроницаемыми — они проницаемы для водорода, но непроницаемы для азота. Пропуская нагретый водород с давлением в 1 атм через больший сосуд, исследователь обнаружит, что давление смеси газов в сосуде Р превысит 1 атм на величину парциального давления азота при данной температуре.
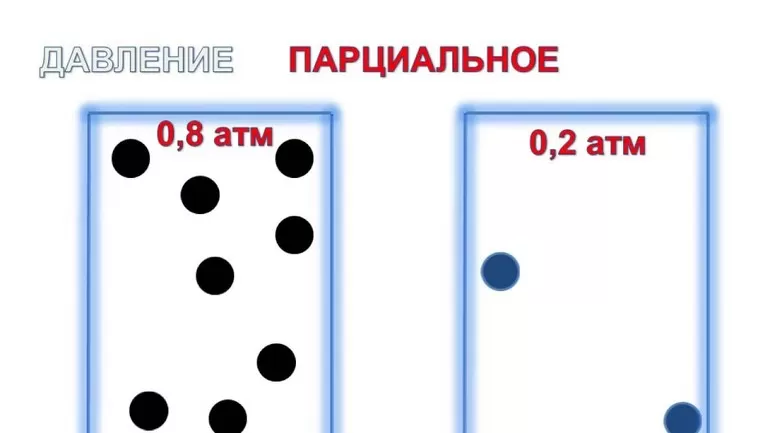
Парциа́льное давление (лат. partialis «частичный» от pars «часть») — давление, которое имел бы газ, входящий в состав газовой смеси, если бы он один занимал объём, равный объёму смеси при той же температуре[1][2][3]. Общее давление газовой смеси является суммой парциальных давлений её компонентов.
В химии парциальное давление газа в смеси газов определяется как указано выше. Парциальное давление газа, растворённого в жидкости, является парциальным давлением того газа, который образовался бы в фазе газообразования в состоянии равновесия с жидкостью при той же температуре. Парциальное давление газа измеряется как термодинамическая активность молекул газа. Газы всегда будут вытекать из области с высоким парциальным давлением в область с более низким давлением; и чем больше разница, тем быстрее будет поток. Газы растворяются, диффундируют и реагируют соответственно их парциальному давлению и не обязательно зависимы от концентрации в газовой смеси.
Законы Дальтона парциального давления[править | править код]
Для идеального газа парциальное давление в смеси равно давлению, которое будет оказываться, если бы он занимал тот же объём, что и вся смесь газов, при той же температуре. Причина этого в том, что между молекулами идеального газа по определению не действуют силы притяжения или отталкивания, их соударения между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями. Насколько условия реально существующей смеси газов близки этому идеалу, настолько общее давление смеси равно сумме парциальных давлений каждого газа смеси, как это формулирует закон Дальтона[4]. Например, дана смесь идеального газа из азота (N2), водорода (H2) и аммиака (NH3):
, где:
= общему давлению в газовой смеси
= парциальному давлению азота (N2)
= парциальному давлению водорода (H2)
= парциальному давлению аммиака (NH3)
Смеси идеальных газов[править | править код]
Мольная доля отдельных компонентов газа в идеальной газовой смеси может быть выражена в пределах парциальных давлений компонентов или молей компонентов:
и парциальное давление отдельных компонентов газов в идеальном газе может быть получено используя следующее выражение:
, где:
= мольной доле любого отдельного компонента газа в газовой смеси
= парциальному давлению любого отдельного компонента газа в газовой смеси
= молям любого отдельного компонента газа в газовой смеси
= общему числу молей газовой смеси
= общему давлению в газовой смеси
Мольная доля отдельного компонента в газовой смеси равна объёмной доле этого компонента в газовой смеси[5].
См. также[править | править код]
- Пар
- Газ, Идеальный газ и Уравнение состояния идеального газа
- Мольная доля и Моль
- Законы Дальтона
- Объёмный процент
- Закон Генри
Примечания[править | править код]
Источник
Парциальное давление и объем
Когда мы имеем дело со смесями газов, важно знать, что они имеют такие характеристики, как парциальный объем и парциальное давление. Для начала определим, что такое смесь идеальных газов.
Определение 1
Смесь идеальных газов — это смесь нескольких газообразных веществ, которые при заданных условиях не будут вступать в определенные химические реакции.
При смене условий (например, повышении температуры, понижении давления) газовая смесь все же может вступать во взаимодействие. Важный параметр любой такой смеси — так называемая весовая концентрация g i i -ного газа-компонента.
Здесь:
- N — количество газов, из которых состоит смесь;
- x i i -го газа — молярная концентрация указанного газа в составе смеси;
- ν i — количество молей i -го газа, присутствующего в смеси.
Понятие парциального давления
Парциальное давление — это особая характеристика, описывающая состояние компонентов смеси идеальных газов. Сформулируем основное определение:
Определение 2
Парциальным называется давление p i , которое могло бы создаваться i -ым газом в смеси при условии отсутствия остальных газов и сохранения исходного объема и температуры.
Формула парциального давления будет выглядеть так:
p i = m i μ i R T V = μ i R T V
Объем смеси здесь обозначен буквой V , ее температура — T .
Следует подчеркнуть, что поскольку средние кинетические энергии молекул смеси равны, то существует и равенство температур всех компонентов газовой смеси, находящейся в состоянии термодинамического равновесия.
Для нахождения давления смеси идеальных газов нужно воспользоваться законом Дальтона в следующей формулировке:
p = ∑ i = 1 N p i = R T V ∑ i = 1 N ν i
Исходя из него, мы можем выразить парциальное давление так:
p i = x i p .
Понятие парциального объема
У газовой смеси также есть такая характеристика, как парциальный объем.
Определение 3
Парциальный объем V i i -газа в газовой смеси — это такой объем, который мог бы иметь газ при условии отсутствия всех остальных газов и сохранении исходной температуры и объема.
Если речь идет о смеси идеальных газов, то к ней применим закон Амага:
V = ∑ i = 1 N V i
В самом деле, при выражении ν i из формулы выше у нас получится следующее:
ν i = p V i R T ; p = R T V p R T ∑ i = 1 N V i → V = ∑ i = 1 N V i
Для расчета парциального объема газа используется следующая формула:
V i = x i V .
Нам известно, что параметры, определяющие состояние смеси идеальных газов, будут подчиняться уравнению Менделеева-Клайперона. Формула будет выглядеть так:
p V = m μ s m R T .
Все параметры данного уравнения будут относиться ко всей смеси. Это же уравнение удобнее записать так:
p V = m R s m T .
Здесь параметры R s m = R μ s m = R ∑ i = 1 N q i μ i означают удельную газовую постоянную смеси.
Пример 1
Условие: имеется сосуд объемом 1 м 3 , в котором находится 0 , 10 · 10 — 3 к г гелия и 0 , 5 · 10 — 3 к г водорода. Постоянная температура равна 290 К . Вычислите давление смеси и парциальное давление гелия в нем.
Решение
Начнем с вычисления количества молей каждого компонента смеси. Для этого можно использовать формулу:
ν i = m i μ i
Зная, что молярная масса водорода, согласно таблице Менделеева, составляет μ H 2 = 2 · 10 — 3 к г м о л ь , мы можем найти количество его молей в смеси по формуле:
ν H 2 = m H 2 μ H 2
Считаем, что получится:
ν H 2 = 0 , 5 · 10 — 3 2 · 10 — 3 = 0 , 25 ( м о л ь ) .
Точно такие же расчеты проводим и для гелия, зная, что μ H e = 4 · 10 — 3 к г м о л ь :
Теперь с помощью уравнения Менделеева-Клайперона можно найти парциальное давление каждого компонента:
p i V = ν i R T .
Сначала рассчитаем давление водорода:
p H 2 V = ν H 2 R T → p H 2 = ν H 2 R T V
Парциальное давление будет равно:
p H 2 = 0 , 25 · 8 , 31 · 290 1 = 602 , 5 ( П а ) .
Теперь то же самое подсчитываем для гелия:
p H e = 0 , 025 · 8 , 31 · 290 1 = 60 , 25 ( П а ) .
Чтобы найти общее давление смеси газов, сложим сумму давлений ее составляющих:
p = p H 2 + p H e
Подставляем полученные ранее значения и находим нужный результат:
p = 602 , 5 + 60 , 25 = 662 , 75 ( П а ) .
Ответ: общее давление смеси составляет 662 , 75 П а , а парциальное давление гелия в смеси равно 60 , 25 П а .
Пример 2
Условие: дана смесь газов, состоящая из 1 к г углекислого газа и 0 , 5 к г O 2 . Если считать их идеальными, какой объем они будут занимать при давлении в 1 а т м ? Температура смеси равна 300 К .
Решение
Начнем с вычисления общей массы газовой смеси.
m = m O 2 + m C O 2
Значит, m = 1 + 0 , 5 = 1 , 5 .
Переходим к вычислению массовых компонентов смеси:
g O 2 = 0 , 5 1 , 5 = 0 , 33 ; g C O 2 = 1 1 , 5 = 0 , 67 .
Тогда газовая постоянная смеси будет равна:
R s m = R ∑ i = 1 N g i μ i
R s m = 8 , 31 0 , 33 32 · 10 — 3 + 0 , 67 46 · 10 — 3 = 200 Д ж к г К .
Объем смеси вычисляем с помощью уравнения Менделеева-Клайперона:
V s m = m s m R s m T s m p s m
Вспомнив, что по условию давление равно 1 а т м , что равно 10 5 П а , вычислим объем:
V s m = 1 , 5 · 200 · 300 10 5 = 0 , 9 м 3 .
Ответ: при указанных условиях смесь займет объем, равный 0 , 9 м 3 .
Источник
Парциальное давление газов — определение, формулы и законы
Трактовка закона
Учёный Дальтон в 1801 году сформировал закон парциальных давлений: Па смеси из идеальных газов равняется сумме рi её компонентов. Уравнение имеет следующий вид: Рсм=n (сумма pi), где n — число долей смеси.
Для определения парциального давления в химии используется отдельный компонент из атмосферного воздуха. При расчете учитывается значение каждого отдельного вещества, их число, температуры с объёмами. При необходимости можно найти общий показатель, сложив давление каждого компонента в отдельности.

Каждый газ в сосуде должен обозначаться как «идеальный». При нормальных условиях они взаимодействуют с углекислым газом, водородом, водой, азотом, водяным паром, кислородом, компонентами крови и прочими компонентами из таблицы Менделеева. При этом не образуются соединения. Отдельные молекулы способны сталкиваться между собой, отталкиваясь, но не деформируясь.
Физические и химические задачи решаются с помощью формулы парциального давления (закон открыли учёные Бойль и Мариотт): (k = P x V). Кроме полного варианта, уравнение записывается сокращённо k = PV, где:
- k равно постоянной величине;
- Р — давление;
- V — объем.
Второстепенные значения
Давление может измеряться в разных величинах: процент, паскаль (Па). Смысл последнего: сила в 1 ньютон приложена к площади в 1 кв. м. Если результат такой зависимости записывается в атмосферах, тогда для его нахождения потребуется учесть, что одна атмосфера равняется 101,325 Па.
Температура идеального газа повышается, если увеличивается объём, а снижается, если уменьшается последний показатель. Такое соотношение может называться законом Чарльза, который имеет следующий математический вид: k = V / T. Значение температуры в уравнении измеряется в градусах Кельвина. Оно зависит от градусов Цельсия. Чтобы его найти, прибавляется 273.
Уравнение используется в химии для определения мольной доли (концентрация, которая выражается через отношение количества молей 1 компонента к суммарному числу молей пары веществ, входящих в смесь). Кроме объёма, для газа характерна молярная масса (вес одной доли компонента) и объём. Существуют легкие способы её подсчёта:
- Стандартная. Измеряется в граммах и килограммах.
- Молекулярная. Так как газы весят мало, их вес вычисляется в специальной единице измерения — молярная масса. Для её определения суммируется вес составных атомов. Каждый компонент сравнивается с массой карбона, равной 12.
Уравнения Дальтона и Бойля
Физик и химик Дальтон считается первым учёным, предположившим структуру атомных элементов, их свойства. Общее давление вычисляется следующим образом: Р= P1 + P2 + P3. Пример: в колбе содержится по 10 г оксигена и нитрогена. Их общее Р будет равно 20 (10+10). Для вычисления pi используется температура, равная 37 градусам Цельсия.
Чтобы перевести её в градусы Кельвина, значение по Цельсию, равное 37, добавляется к 273. Результат — 310. Для вычисления количества молей газов используется масса, поделённая на молярную. Если уравнение касается нитрогена, вес каждого компонента соответствует цифре 14.

Так как вещество содержит в себе 2 атома, то 14х2, что равно 28. Масса в граммах делится на полученный результат. Таким способом вычисляется количество молей, приблизительно равное 0,4 моль. Чтобы найти аналогичное значение у оксигена, применяется масса 16. Вещество относится к двухатомным газам, поэтому 16х2 равняется 32. По результатам получается, что 0,3 моль оксигена содержится в составе газовой смеси.
Если в задаче указывается общее давление и pi в атмосферах, тогда используется в качестве константы R (0.0821 л атм/K моль). При подстановке данных в уравнение можно узнать Pобщее. Чтобы вычислить ПД нитрогена, 0,4 моль умножается на константу и температуру. Результат делится на 2 литра, что приблизительно равно 5.09 атм. Аналогичные шаги выполняются для вычисления ПД оксигена. Конечный результат равен 3.82 атм.
Свойства веществ
Значение pi газа, растворённого в жидкости, равняется pi того вещества, который образовался бы в фазе газообразования в случае равновесия с жидкостью при аналогичной температуре. Парциальное давление (ПД) измеряется в качестве термодинамической активности молекул вещества.
Газы постоянно вытекают из сферы с высоким ПД в область с низким давлением. Чем больше такая разница, тем быстрее поток. Газам свойственно растворяться, диффундировать, реагировать на ПД. В некоторых случаях показатель не зависит от концентрации газовой смеси.

При решении задач в области химии и физики учитываются свойства газов: сжимаемость и способность расширяться. Они не имеют своей формы, поэтому расширяются до заполнения сосуда, принимая его форму. По аналогичной причине они не имеют объёма. Газ давит на стенки ёмкости по всем направлениям одинаково. Характерное свойство компонентов — способность смешиваться между собой в разных соотношениях.
Так как объём зависит от температуры и давления, поэтому в норме должно быть 0 °C и 760 мм рт. ст. При этом нет места влаги. Если объём считается нормальным, его обозначают стоящей впереди буквой. Подобная зависимость отображается в термодинамике с помощью графика. Если доказана зависимость объема от давления, при этом температура постоянная, используются изотермы (линии, которые изображают на диаграмме процесс с неизменной температурой).
Точки и функции
В законе Бойля чётко указана зависимость объёма от давления при одинаковой температуре. Если данные нанести на график в функцию давления, через точки можно будет провести кривую. Точный эксперимент и незначительный разброс точек позволяют описать объёмное поведение системы с небольшой погрешностью.
Несколько подобных кривых для разных температур во всём диапазоне изученных условий позволяет описать объёмное поведение газа. Одновременно отображаются кривые постоянного давления, которые описывают изменения основных показателей. Чтобы получить окончательные результаты, кривые требуют незначительного сглаживания. Подобные графики сделать самостоятельно менее сложно.
Объём газа при неизменной температуре сильно изменяется с колебаниями давления. Но графически представить такую зависимость в широком диапазоне изменения давлений трудно. Если охвачена широкая область изменения, используются крупные масштабы.
Для упрощения процесса построения на график наносится зависимость произведения Р от давления при одной температуре, что существенно уменьшает область выявления функции. Наибольший эффект получается от применения 1−2 специальных функций объёма, которые называются коэффициентом сжимаемости и остаточным объёмом.
Каждое понятие характеризуется объёмным поведением газа с учётом его отклонений от нормального состояния вещества и созданных идеальных условий. Чтобы упростить поставленную задачу, график отображается на специальной бумаге либо при помощи компьютерных программ. Во втором случае достаточно ввести данные. Сервис самостоятельно строит прямые, кривые и прочие элементы графика.
Простые зависимости лучше отображать в стандартных программах Word. Графические сложные задачи в химии и физике решаются с помощью «Agrafer» — известная компьютерная программа, которая используется не только студентами, но и школьниками.
Источник
Парциальное давление — Partial pressure
Давление, относящееся к компоненту газа в смеси
В смеси газов , каждый составляющий газ имеет парциальное давление , которое является условным давлением этого составляющего газа, если только он занимал весь объем исходной смеси при том же температура . Общее давление смеси идеального газа является суммой парциальных давлений газов в смеси (закон Дальтона ).
Парциальное давление газа является мерой термодинамической активности молекул газа. Газы растворяются, диффундируют и реагируют в соответствии с их парциальным давлением, а не в соответствии с их концентрациями в газовых смесях или жидкостях. Это общее свойство газов справедливо и для химических реакций газов в биологии. Например, количество кислорода, необходимое для дыхания человека и количество токсичных веществ, определяется парциальным давлением только кислорода. Это верно для очень широкого диапазона различных концентраций кислорода, присутствующего в различных вдыхаемых газах для дыхания или растворенного в крови. Парциальные давления кислорода и углекислого газа являются важными параметрами при тестировании газов артериальной крови , но также могут быть измерены, например, в спинномозговой жидкости .
Символ
Символом для давления обычно является P или p, может использовать нижний индекс для обозначения давления, и газы также обозначаются нижним индексом. При объединении эти индексы применяются рекурсивно.
Примеры:
P 1 { displaystyle {P_ {1}}} или p 1 { displaystyle {p_ {1 }}} = давление в момент времени 1 PH 2 { displaystyle {P _ { rm {H_ {2}}}}} или p H 2 { displaystyle {p _ { rm {H_ {2}}}}} = парциальное давление водорода P v O 2 { displaystyle {P_ {v _ { rm {O_ {2}} }}}} или pv O 2 { displaystyle {p_ {v _ { rm {O_ {2}}}}}} = венозное парциальное давление кислорода
Закон Дальтона о парциальных давлениях
Закон Дальтона выражает тот факт, что полное давление смеси газов равно сумме парциальных давлений отдельных газов в смеси. Это равенство возникает из-за того, что в идеальном газе молекулы настолько удалены друг от друга, что не взаимодействуют друг с другом. Большинство реальных газов очень близко подходят к этому идеалу. Например, для идеальной газовой смеси азота (N2), водорода (H2) и аммиака (NH 3 ):
p = п N 2 + п ЧАС 2 + п NH 3 { displaystyle p = p _ {{ ce {N2}}} + p _ {{ ce {H2}}} + p _ {{ ce {NH3}}}}
Схема, показывающая концепцию закона Дальтона.
Идеальные газовые смеси
В идеале отношение парциальных давлений равно отношению числа молекул. То есть мольная доля xi { displaystyle x _ { mathrm {i}}} отдельного газового компонента в идеальном газе смесь может быть выражена через парциальное давление компонента или моль компонента:
xi = pip = nin { d isplaystyle x _ { mathrm {i}} = { frac {p _ { mathrm {i}}} {p}} = { frac {n _ { mathrm {i}}} {n}}}
и парциальное давление отдельного газового компонента в идеальном газе может быть получено с помощью этого выражения:
pi = xi ⋅ p { displaystyle p _ { mathrm {i}} = x _ { mathrm {i}} cdot p }
мольная доля газового компонента в газовой смеси равно объемной доле этого компонента в газовой смеси.
Отношение парциальных давлений основывается на следующем соотношении изотерм:
VXV tot = p X ptot = п Икс ntot { displaystyle { frac {V _ { rm {X}}} {V _ { rm {tot}}}} = { frac {p _ { rm {X}}} {p _ { rm { tot}}}} = { frac {n _ { rm {X}}} {n _ { rm {tot}}}}}
- VX- частичный объем любого отдельного компонента газа (X)
- Vtot — общий объем газовой смеси;
- pX- парциальное давление газа X
- ptot — полное давление газовой смеси
- nX- количество вещества газа (X)
- ntot — общее количество вещества в газовой смеси
Парциальный объем (закон аддитивного объема Амагата)
Парциальный объем конкретный газ в смеси — это объем одного компонента газовой смеси. Это полезно в газовых смесях, например воздух, чтобы сосредоточиться на одном конкретном компоненте газа, например кислород.
Его можно приблизительно вычислить как по парциальному давлению, так и по молярной доле:
VX = V tot × p X ptot = V tot × n X ntot { displaystyle V _ { rm {X}} = V_ { rm {tot}} s { frac {p _ { rm {X}}} {p _ { rm {tot}}}} = V _ { rm {tot}} s { frac {n _ { rm {X}}} {n _ { rm {tot}}}}}
- VX- парциальный объем отдельного компонента газа X в смеси
- Vtot — общий объем газовой смеси
- pX- парциальное давление газа X
- ptot — полное давление газовой смеси
- nX- количество вещества в газе X
- ntot — общее количество вещества в газовой смеси
Давление пара
Диаграмма логарифмического давления пара для различных жидкостей
Давление пара — это давление пара , находящегося в равновесии с его непаровые фазы (т.е. жидкие или твердые). Чаще всего этот термин используется для описания тенденции жидкости к испарению . Это мера тенденции молекул и атомов к выходу из жидкости или твердого вещества . Точка кипения жидкости при атмосферном давлении соответствует температуре, при которой давление ее пара равно окружающему атмосферному давлению, и ее часто называют нормальной точкой кипения .
. Чем выше давление пара жидкости при данной температуре, тем ниже нормальная температура кипения жидкости.
На отображаемой диаграмме давления пара есть графики зависимости давления пара от температуры для различных жидкостей. Как видно из диаграммы, жидкости с самым высоким давлением пара имеют самую низкую нормальную температуру кипения.
Например, при любой заданной температуре, метилхлорид имеет самое высокое давление пара среди всех жидкостей в таблице. Он также имеет самую низкую нормальную точку кипения (-24,2 ° C), в которой кривая давления паров хлористого метила (синяя линия) пересекает горизонтальную линию давления одной атмосферы (атм ) абсолютного пара. давление. Обратите внимание, что на больших высотах атмосферное давление ниже, чем на уровне моря, поэтому точки кипения жидкостей снижаются. На вершине горы Эверест атмосферное давление составляет примерно 0,333 атм, поэтому, используя график, температура кипения диэтилового эфира будет примерно 7,5 ° C по сравнению с 34,6 ° C при уровень моря (1 атм).
Константы равновесия реакций с участием газовых смесей
Можно вычислить константу равновесия для химической реакции с участием смеси газов с учетом парциального давления каждого газа и общая формула реакции. Для обратимой реакции с участием газовых реагентов и газовых продуктов, например:
a A + b B ↔ c C + d D { displaystyle a , A + b , B leftrightarrow c , C + d , D}
константа равновесия реакции будет:
K p = p C cp D dp A ap B b { displaystyle K_ {p} = { frac {p_ {C} ^ {c} , p_ {D} ^ {d}} {p_ {A} ^ {a} , p_ {B} ^ {b}}}}
Для обратимых реакций изменения общего давления, температуры или концентрации реагентов будут сдвигать равновесие , поэтому в пользу правой или левой стороны реакции в соответствии с Принципом Ле Шателье . Однако кинетика реакции может либо противодействовать, либо усиливать сдвиг равновесия. В некоторых случаях кинетика реакции может быть решающим фактором, который следует учитывать.
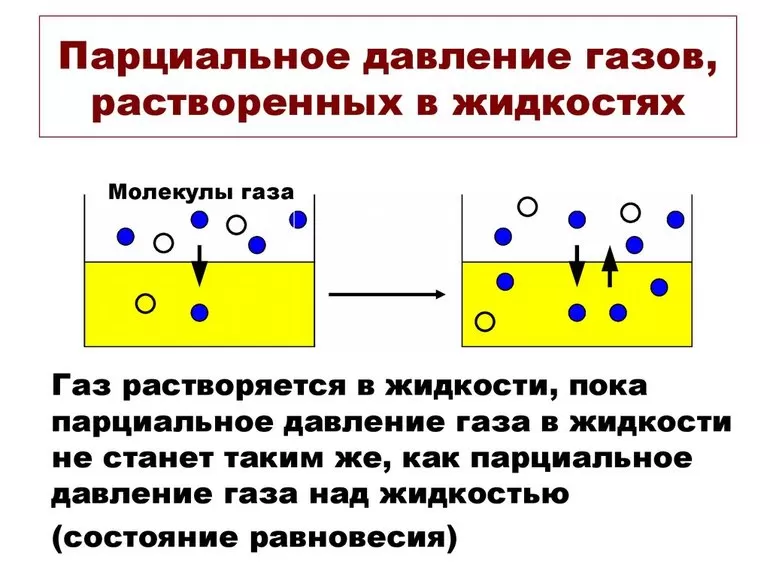
Закон Генри и растворимость газов
Газы будут растворяться в жидкостях до степени, которая определяется равновесием между нерастворенным газом и газ, растворенный в жидкости (называемый растворителем ). Константа равновесия для этого равновесия:
(1) k = px C x { displaystyle k = { frac {p_ {x}} {C_ {x}}}}
Форма константы равновесия показывает, что концентрация растворенного вещества в растворе прямо пропорциональна парциальное давление этого газа над раствором . Это утверждение известно как закон Генри , а константа равновесия k { displaystyle k} довольно часто упоминается как константа закона Генри.
закон иногда записывается как:
(2) k ′ = C xpx { displaystyle k ‘= { frac {C_ {x}} {p_ {x}}}}
где k ′ { displaystyle k ‘} также называется постоянной закона Генри. Как видно из сравнения уравнений (1) и (2) выше, k ′ { displaystyle k ‘} является обратной величиной k { displaystyle k} . Поскольку и то и другое можно назвать константой закона Генри, читатели технической литературы должны быть очень осторожны, чтобы отметить, какая версия уравнения закона Генри используется.
Закон Генри — это приближение, которое применяется только к разбавленным идеальным растворам и к растворам, в которых жидкий растворитель не химически реагирует с растворяемым газом.
При погружении с газами для дыхания
В подводном плавании физиологические эффекты отдельных составляющих газов газов для дыхания являются функцией парциального давления.
Используя термины ныряния, парциальное давление рассчитывается как:
парциальное давление = (общее абсолютное давление) × (объемная доля газового компонента)
Для газового компонента «i»:
pi= P × F i
Например, на глубине 50 метров (164 фута) под водой общее абсолютное давление составляет 6 бар (600 кПа) (т. Е. 1 бар атмосферного давления + 5 бар давления воды) и парциальные давления основных компонентов воздуха , кислорода 21% по объему и азота примерно 79% по объему составляют:
pN2= 6 бар × 0,79 = 4,7 бар абс. pO2= 6 бар × 0,21 = 1,3 бар абс.
Минимальный безопасный нижний предел парциального давления кислорода в газовая смесь составляет 0,16 бар (16 кПа) абс. Гипоксия и внезапная потеря сознания становятся проблемой при парциальном давлении кислорода менее 0,16 бар абсолютного давления. Кислородное отравление , включая судороги, становится проблемой, когда парциальное давление кислорода слишком высокое. NOAA Руководство по дайвингу рекомендует максимальное однократное воздействие: 45 минут при абсолютном давлении 1,6 бар, 120 минут при абсолютном давлении 1,5 бара, 150 минут при абсолютном давлении 1,4 бара, 180 минут при абсолютном давлении 1,3 бара и 210 минут. при абсолютном давлении 1,2 бара. Кислородное отравление становится риском, когда эти парциальные давления кислорода превышаются. Парциальное давление кислорода определяет максимальную рабочую глубину газовой смеси.
Наркоз — проблема при вдыхании газов под высоким давлением. Обычно максимальное общее парциальное давление наркотических газов, используемое при планировании технического дайвинга , может составлять около 4,5 бар абсолютного давления, исходя из эквивалентной наркотической глубины в 35 метров (115 футов).
Воздействие токсичного загрязнителя, такого как оксид углерода на вдыхаемый газ, также связано с парциальным давлением при вдыхании. Смесь, которая может быть относительно безопасной на поверхности, может быть опасно токсичной на максимальной глубине погружения, или допустимый уровень углекислого газа в дыхательном контуре ныряющего ребризера может становятся невыносимыми в течение нескольких секунд во время спуска, когда парциальное давление быстро увеличивается, и может привести к панике или выведению из строя дайвера.
В медицине
Парциальное давление кислорода (p O 2 { displaystyle p _ {{ mathrm {O}} _ {2}}} ) и диоксид углерода (p CO 2 { displaystyle p _ {{ mathrm {CO}} _ {2}}} ) являются важными параметрами при тестировании газов артериальной крови , но также может быть измерено, например, в спинномозговой жидкости .
Референсные диапазоны для p O 2 { displaystyle p _ {{ mathrm {O}} _ {2}} } и p CO 2 { displaystyle p _ {{ mathrm {CO}} _ {2}}}
| Unit | Газ артериальной крови | Венозная кровь газ | Цереброспинальная жидкость | Альвеолярный легочный давление газа | |
|---|---|---|---|---|---|
| p O 2 { displaystyle p _ {{ mathrm {O}} _ {2}}} | кПа | 11-13 | 4,0-5,3 | 5,3-5,9 | 14,2 |
| мм рт. Ст . | 75-100 | 30-40 | 40-44 | 107 | |
| p CO 2 { displaystyle p _ {{ mathrm {CO}} _ {2}}} | кПа | 4,7-6,0 | 5,5-6,8 | 5,9-6,7 | 4,8 |
| мм рт. Ст . | 35-45 | 41-51 | 44-50 | 36 |
См. Также
- Газ для дыхания — Газ, используемый для дыхания человека
- Закон Генри — Отношение равновесной растворимости газа в жидкости к его парциальному давлению в контактирующей газовой фазе
- Идеальный газ — Математическая модель, которая аппроксимирует поведение реальных газов
- Закон идеального газа — Уравнение состояния гипотетического идеального газа
- Мольная доля — Доля составляющая к общему количеству всех составляющих в смеси, выраженная в моль / моль
- Моль (единица) — единица измерения количества вещества в системе СИ
- Пар — Вещества в газовой фазе при температура ниже критической точки
Литература
Источник