Каким будет раствор по отношению к плазме крови осмотическим давлением
Содержание статьи
Медицинская биохимия, принципы измерительных технологий в биохимии, патохимия, диагностика, биохимия злокачественного роста. Часть 2.
Вода и электролиты
3. Осмотическое давление и осмоляльность
3.2. Осмоляльность плазмы
ОСМОТИЧЕСКАЯ АКТИВНОСТЬ (КОНЦЕНТРАЦИЯ)
Осмотическая активность биологической жидкости определяется концентрацией осмотически активных веществ и создаётся недиссоциирующими соединениями и электролитами. Данная активность (соответствующая 1 л раствора) выражается в миллиосмолях (мосм), равных миллиэквивалентам (мэкв) одновалентных ионов (для них также справедливо соотношение мэкв/л = ммоль/л.)
Соли типа натрия хлорида полностью диссоциируют в воде, поэтому конечная осмотическая активность раствора вдвое больше концентрации каждого электролита.
Напротив, глюкоза не диссоциирует в воде, следовательно, осмотическая активность её количества, равного 1 ммоль и содержащегося в 1 л раствора, составит 1 мосм. Для выражения степени осмотической активности (концентрации) раствора используют следующие понятия.
Осмолярность — число осмолей растворённого вещества, содержащегося в 1 л раствора. Осмоляльность — число осмолей растворённого вещества, содержащегося в 1 кг растворителя.
У биологических жидкостей разница между осмоляльностью и осмолярностью незначительна, поэтому указанные термины могут иметь одинаковое смысловое значение в клинической медицине.
ОСМОЛЯЛЬНОСТЬ И ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ
Под осмотическим давлением, или эффективной осмоляльностью, подразумевают разницу осмотической активности двух растворов, разделённых полупроницаемой мембраной (на два отсека), через которую свободно проходят только молекулы воды (растворитель). Данная разница создаёт осмотический градиент для движения воды из раствора с низкой концентрацией в раствор с более высокой осмотической концентрацией. Вместе с тем существуют вещества, которые, будучи растворёнными, способствуют повышению осмоляльноста раствора в каждом из двух отсеков без возрастания осмотического давления. В качестве примеров таких веществ, приводящих к гиперосмоляльности растворов без повышения осмотического давления, можно привести мочевину и спирты (этанол, метанол, этиленгликоль и др.) *
ОСМОЛЯЛЬНОСТЬ ПЛАЗМЫ КРОВИ
Осмоляльность плазмы крови (внеклеточная жидкость) можно измерить в лаборатории, используя определение точки замерзания — криоскопическои константы. (Температура замерзания растворов осмотически активных веществ ниже точки замерзания воды, 00С, поэтому для каждой концентрации существует своя криоскопическая константа.) Образец плазмы крови помещают в морозильную камеру и регистрируют точку замерзания, затем по ней определяют осмоляльность этой биологической жидкости (например, одноосмоляльные растворы замерзают при температуре -1,86 °С).
Осмоляльность плазмы также можно вычислить, исходя из содержания в ней натрия, хлора, глюкозы и мочевины (главные осмотические компоненты внеклеточной жидкости). В расчёте, приведённом ниже, использованы следующие данные: концентрация натрия составляет 140 мэкв/л, глюкозы — 5 ммоль/л, мочевины крови — 5 ммоль/л .
Осмоляльность плазмы = 2 х Na + глюкоза (ммоль/л) + мочевина (ммоль/л)
= 2 х (140) + 5 + 5 = 290 мосм/кг Н2О
ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ ПЛАЗМЫ
Эффективная осмоляльность, или осмотическое давление плазмы, можно вычислить по аналогичной формуле, предварительно исключив из неё выражение, обозначающее концентрацию азота мочевины крови (вследствие способности мочевины свободно проникать сквозь клеточные мембраны и тем самым не создавать осмотического градиента между внеклеточной и внутриклеточной жидкостью).
Осмотическое давление плазмы = 2 х Na + глюкоза (ммоль/л)
= 2 х (140) + 5 = 285 мосм/кг Н2О
Разница между осмоляльностью плазмы и её осмотическим давлением у здоровых людей очень незначительна из-за малой концентрации мочевины во внеклеточной жидкости. В случае азотемии указанная разница существенно возрастает. Однако при чистых гиперосмолярных синдромах, не сопровождающихся повышенным осмотическим давлением, не происходит диффузии воды через клеточные мембраны и, следовательно, последствия таких расстройств незначительные.
ОСМОЛЯЛЬНАЯ РАЗНИЦА
Разность между измеренным и подсчитанным по формуле значением осмоляльности плазмы соответствует концентрации других осмотически активных веществ, не учтённых при вычислении (например, магний, кальций, белки и др.). Подобную разность называют осмоляльной разницей (в норме она составляет 10 мэкв/л или меньше) [4].
Повышенную осмоляльную разницу следует интерпретировать, исходя из значений вычисленной осмоляльности плазмы. Если вычисленная осмоляльность незначительна, то уменьшен объём жидкой части плазмы в результате гиперпротеинемии или гиперлипидемии. Если значение осмоляльности плазмы находится в пределах нормы, то увеличенная осмоляльная разница свидетельствует о присутствии токсинов (этанол, метанол, этиленгликоль) или других осмотически активных веществ, таких, как маннит либо трудноидентифицируемые средние молекулы, накапливающиеся при почечной недостаточности. Определение осмоляльной разницы можно использовать для дифференциации острой и хронической почечной недостаточности. При острой почечной недостаточности осмоляльная разница будет нормальной, а при хронической — повышенной [4].
- Rose BD. New approach to disturbances in the plasma sodium concentration. Am J Med 1986; 81:1033-1040.
- Alvis R, Geheb M, Cox M. Hypo- and hyperosmolar es: Diagnostic approaches. In: ArieffAl, DeFronzo R eds. Fluid, electrolyte and acid-base disorder. New York: Churchill Livingstone, 1985; 185-221.
- Narins RG, Jones ER, Stom MC, et al. Diagnostic strategies in disorders of fluid, electrolyte and acid-base homeostasis. Am J Med 1982; 72: 496-520.
ГИПЕРНАТРИЕМИЯ
- Geheb M. Clinical approach to the hyperosmolar patient. Crit Care Clin 1987; 5:797-815.
- Katz MA. Hyperglycemia-induced hyponatremia-calculation of expected serum sodium depression. N Engi J Med 1973; 289:843-844.
- Moran SM, Jamison RL. The variable hyponatremic response to hyperglycemia. West J Med 1985; 142:49-53.
- Feig PU. Hypernatremia and hypertonic syndromes. Med Clin North Am 1981; 65:271-290.
- Khadori R, Soler NG. Hyperosmolar hyperglycemic nonketotic syndrome. Am J Med 1984; 77:899-903.
- Daugirdas JT, Kronfol NO, Tzamaloukas AH, Ing TS. Hyperosmolar coma: Cellular dehydration and the serum sodium concentration. Ann Intern Med 1989; 10:855-857.
ГИПОНАТРИЕМИЯ
- Arieff Al. Osmotic failure: Physiology and strategies for treatment. Hosp Pract 1988; 22:131-152.
- Anderson RJ, Chung HM, Kluge R, Schrier RW. Hyponatremia: A prospective analysis of its epidemiology and the pathogenic role of vasopressin. Ann Intern Med 1985; 102:164-168.
- Chung HM, Kluge R, Schrier RW, Anderson RA. Postoperative hyponatremia. A prospective study. Arch Intern Med 1985; 146:333-336.
- Weisberg LS. Pseudohyponatremia: A reappraisal. Am J Med 1988; 86:315-318.
- Ayus JC, Krothapalli RK, Arieff Al. Changing concepts in treatment of severe symptomatic hyponatremia. Am J Med 1985; 78:897-902.
- Dubois GD, Arieff Al: Symptomatic hyponatremia: The case for rapid correction. In: Narins RG ed. Controversies in Nephrology and Hypertension. New York: Churchill Livingstone, 1984; 393-407.
Источник
Нарушения метаболизма. Биохимия специализированных тканей. (Для клин.ордов КЛД)
Осмолярность — сумма концентраций катионов анионов и неэлектролитов, т.е. всех кинетически активных частиц в 1л. раствора. Она выражается в миллиосмолях на литр (мосм/л). Осмоляльность — концентрация тех же частиц, растворенных в килограмме воды, выражающаяся в миллиосмолях на килограмм (мосм/кг).
Осмоти́ческая концентра́ция — суммарная концентрация всех растворённых частиц.
Может выражаться как осмолярность (осмоль на литр раствора) и как осмоляльность (осмоль на килограмм растворителя).
Осмо́ль — единица осмотической концентрации, равная осмолярности, получаемой при растворении в одном литре растворителя одного моля неэлектролита. Соответственно, раствор неэлектролита с концентрацией 1 моль/л имеет осмолярность 1 осмоль/литр.
Осмолярность электролита зависит от его концентрации, коэффициента диссоциации и числа ионов, на которые он диссоциирует:
osm=ФnC
где Φ — коэффициент диссоциации, принимает значения от 0 (для неэлектролита) до 1 (полная диссоциация), n — количество частиц, на которые диссоциирует молекула (например, для NaCl n = 2, для H2SO4 n = 3), C — молярная концентрация раствора.
Так, если NaCl при растворении диссоциирует на Na+ и Cl−, и в разбавленных растворах диссоциирует нацело (Φ = 1), то осмолярность 1-молярного раствора NaCl составит 2 осмоль/л, в концентрированных растворах Φ может быть 0,8, тогда осмолярность 1-молярного раствора составит 1,6 осмоль/л.
От осмолярности зависят депрессия точки замерзания (чем выше осмолярность, тем ниже температура замерзания раствора), повышение точки кипения (чем выше осмолярность, тем выше температура кипения) и осмотическое давление.
Осмотическое давление (обозначается π) — избыточное гидростатическое давление на раствор, отделённый от чистого растворителя полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану (осмос). Это давление стремится уравнять концентрации обоих растворов вследствие встречной диффузии молекул растворённого вещества и растворителя.
Мера градиента осмотического давления, то есть различия водного потенциала двух растворов, разделённых полупроницаемой мембраной, называется тоничностью. Раствор, имеющий более высокое осмотическое давление по сравнению с другим раствором, называется гипертоническим, имеющий более низкое — гипотоническим.
Осмотическое давление может быть весьма значительным. В дереве, например, под действием осмотического давления растительный сок (вода с растворёнными в ней минеральными веществами) поднимается по ксилеме от корней до самой верхушки. Одни только капиллярные явления не способны создать достаточную подъёмную силу — например, секвойям требуется доставлять раствор на высоту до 100 метров. При этом в дереве движение концентрированного раствора, каким является растительный сок, ничем не ограничено.
Взаимодействие эритроцитов с растворами в зависимости от их осмотического давления.
Если же подобный раствор находится в замкнутом пространстве, например, в клетке крови, то осмотическое давление может привести к разрыву клеточной мембраны. Именно по этой причине лекарства, предназначенные для введения в кровь, растворяют в изотоническом растворе, содержащем столько хлорида натрия (поваренной соли), сколько нужно, чтобы уравновесить создаваемое клеточной жидкостью осмотическое давление. Если бы вводимые лекарственные препараты были изготовлены на воде или очень сильно разбавленном (гипотоническом по отношению к цитоплазме) растворе, осмотическое давление, заставляя воду проникать в клетки крови, приводило бы к их разрыву. Если же ввести в кровь слишком концентрированный раствор хлорида натрия (3-10 %, гипертонические растворы), то вода из клеток будет выходить наружу, и они сожмутся. В случае растительных клеток происходит отрыв протопласта от клеточной оболочки, что называется плазмолизом. Обратный же процесс, происходящий при помещении сжавшихся клеток в более разбавленный раствор, — соответственно, деплазмолизом.
Величина осмотического давления, создаваемая раствором, зависит от количества, а не от химической природы растворенных в нём веществ (или ионов, если молекулы вещества диссоциируют), следовательно, осмотическое давление являетсяколлигативным свойством раствора. Чем больше концентрация вещества в растворе, тем больше создаваемое им осмотическое давление. Это правило, носящее название закона осмотического давления, выражается простой формулой, очень похожей на некий закон идеального газа:
,
где i — изотонический коэффициент раствора; C — молярная концентрация раствора, выраженная через комбинацию основных единиц СИ, то есть, в моль/м³; R -универсальная газовая постоянная; T — термодинамическая температура раствора.
Это показывает также схожесть свойств частиц растворённого вещества в вязкой среде растворителя с частицами идеального газа в воздухе. Правомерность этой точки зрения подтверждают опыты Ж. Б. Перрена (1906): распределение частичек эмульсии смолы гуммигута в толще воды в общем подчинялось закону Больцмана.
Осмотическое давление, которое зависит от содержания в растворе белков, называется онкотическим (0,03-0,04 атм). При длительном голодании, болезни почек концентрация белков в крови уменьшается, онкотическое давление в крови снижается и возникают онкотические отёки: вода переходит из сосудов в ткани, где πОНКбольше. При гнойных процессах πОНК в очаге воспаления возрастает в 2-3 раза, так как увеличивается число частиц из-за разрушения белков.
В организме осмотическое давление должно быть постоянным (около 7,7 атм). Поэтому пациентам вводят изотонические растворы (растворы, осмотическое давление которых равно πплазмы ≈ 7,7 атм. (0,9 % NaCl — физиологический раствор, 5 % раствор глюкозы). Гипертонические растворы, у которых π больше, чем πплазмы, применяются в медицине для очистки ран от гноя (10 % NaCl), для удаления аллергических отёков (10 % CaCl2, 20 % глюкоза), в качестве слабительных лекарств (Na2SO4∙10H2O, MgSO4∙7H2O).
Закон осмотического давления можно использовать для расчёта молекулярной массы данного вещества (при известных дополнительных данных).
Осмоляльность отражает общее число частиц в 1 кг растворителя. Осмоляльность внеклеточной жидкости создается в основном натрием и эквимолярным количеством анионов, таким образом, она примерно равна удвоенной концентрации натрия — 280-300 мосм/кг. Вода свободно перемещается между внутри- и внеклеточным пространством; если осмоляльность внеклеточной жидкости возрастает, вода выходит из клеток, и наоборот — когда осмоляльность внеклеточной жидкости падает, вода переходит в клетки (так развивается, например, отек мозга при гипонатриемии).
Источник
Учение о растворах
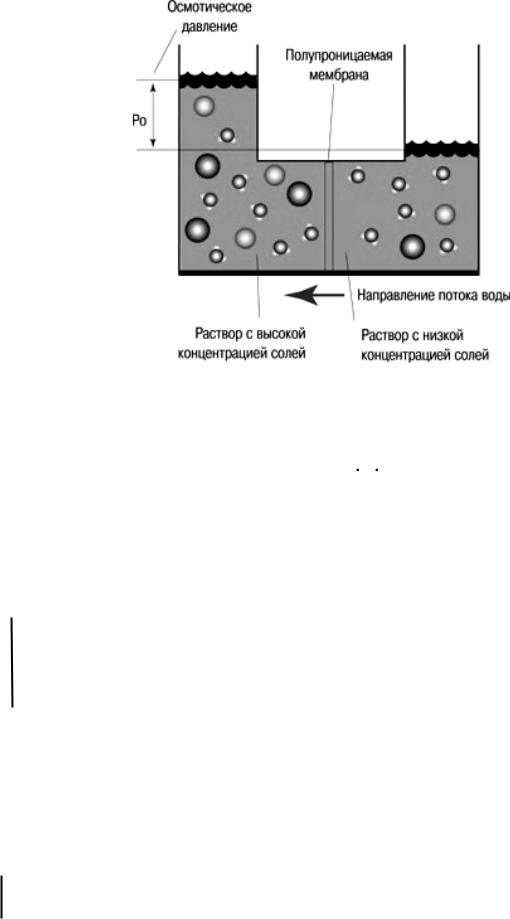
Рис. 6. Схема возникновения осмотического давления
Вант Гофф предложил эмпирическое уравнение для расчета осмотического давления разбавленных растворов неэлектролитов:
Росм(Х) = с(Х) R T,
где с(Х) — молярная концентрация вещества в растворе, моль/л.
По форме это уравнение аналогично уравнению КлапейронаМенделеева для идеальных газов, поэтому несмотря на то, что эти уравне-
ния описывают разные процессы, Вант Гофф сформулировал следующий закон:
Осмотическое давление равно тому давлению, которое оказывало бы растворенное вещество, если бы оно, находясь в газообразном состоянии, занимало при той же температуре объем, равный объему раствора.
Как упоминалось выше, коллигативные свойства не зависят от природы растворѐнного вещества, следовательно, они характерны для идеальных растворов, в которых отсутствуют межмолекулярные взаимодействия и которые не существуют в природе. Для учѐта межмолекулярных взаимодействий в реальных растворах Вант-Гофф предложил использовать изотонический коэффициент.
Изотонический коэффициент (i) — это параметр, учитывающий межмолекулярные взаимодействия в реальных растворах:
20

i | число частиц растворенн ого вещества |
число частиц исходного вещества
i = 1 — для разбавленных растворов неэлектролитов; i > 1 — для разбавленных растворов электролитов;
i < 1 — для коллоидных растворов, содержащих ассоциаты.
Взаимосвязь изотонического коэффициента со степенью диссоциации ( ) выражается уравнением:
i = 1 + (n-1)
где n — число ионов, образующих данный электролит.
Для растворов электролитов осмотическое давление рассчитывается по формуле:
Росм(Х) = i с(Х) R T
Для плазмы крови Росм = 740-780 кПа.
Плазма крови сложная многокомпонентная система, поэтому для учѐта еѐ осмотических свойств было введено понятие осмолярной (осмолярность) или осмоляльной (осмоляльность) концентраций, разница между которыми незначительна вследствие относительной разбавленности биологических растворов.
Осмолярная концентрация — количество всех кинетически активных частиц, содержащихся в 1 л раствора, независимо от их формы, размера и природы.
сосм = i с(Х)
Осмолярная концентрация плазмы крови равна
0,29-0,31 осмоль/л.
Осмоляльность — концентрация осмотически активных частиц в растворе, выраженная в количестве осмоль на килограмм растворителя (осм/кг).
Внорме осмоляльность плазмы (Опл) определяется концентрацией Na+, мочевины и глюкозы.
Внорме осмоляльность плазмы составляет 275-290 мосм/кг. Осмоляльность плазмы сохраняется постоянной благодаря механизмам, способным реагировать на изменения, равные 1-2% ее исходной величины
Осмоляльность является показателем осмотической концентрации и
связана с числом растворенных частиц. Она определяется степенью диссоциации или, наоборот, ассоциации молекул, присутствующих в данной массе раствора. Осмоляльность выражается в (ммоль/кг. Осмоляльность
21
часто путают с осмолярностью, которая определяется как количество частиц в данном объеме раствора (т.е. в ммоль/л). Осмолярность и осмоляльность такого раствора как моча обычно совпадают и различить их расхождения в обычной биохимической лаборатории не представляется возможным. Осмоляльность мочи или других тканевых жидкостей может быть выражена через осмотическое давление. Если раствор отделить от растворителя полупроницаемой мембраной, то растворитель будет стремиться перейти в раствор. Гидростатическое давление, которое должно уравнять давление растворителя, и будет соответствовать осмотическому давлению, определяемому осмоляльностью раствора. В случае клеточной мембраны осмотическое давление зависит от концентрации частиц, которые не проходят через мембрану («эффективная» осмомоляльность или тоничность среды).
Одна из основных функций почек — экскреция растворимых веществ и их производных. Большинство веществ выводятся из организма именно через почки. Так как имеется почечный порог для большинства компонентов мочи, то основными растворенными в моче веществами являются хлорид натрия и мочевина. Количество экскретируемого хлорида натрия составляет от 5 до 25 граммов за 24 часа; количество мочевины за это же время составляет от 10 до 40 граммов. Количество солей в моче отражает их содержание в пище, количество мочевины — потребление белка.
Относительная плотность или удельный вес, которая определяется количеством растворенных веществ в моче, является одним из самых традиционных тестов, который входит в состав общего анализа мочи. Осмоляльноть является более строгим показателем, чем относительная плотность. Она зависит от числа частиц, содержащихся в растворе, тогда как относительная плотность зависит как от числа, так и от характера растворенных частиц. Осмоляльность и плотность мочи тесно связаны между собой, однако преимуществом использования единиц осмоляльности является возможность сравнения мочи с кровью, что предоставляет большие возможности в распознавании почечной активности. Одним из принципиальных преимуществ измерения осмоляльности, а не плотности мочи является то, что белок и глюкоза не так сильно влияют на осмоляльность, как на плотность (удельный вес). На увеличение в моче глюкозы, белка, лекарств или их метаболитов, маннитола или декстранов (в результате внутривенного введения) косвенно указывает нарушение линейной связи между относительной плотностью и осмоляльностью при значениях относительной плотности свыше 1,030 г/мл.
Измерение осмоляльности мочи и сыворотки позволяет определить концентрирующую способность почек. У здоровых людей осмоляльность может меняться от 50 до 1000 ммоль/кг, что соответствует колебанию относительной плотности от 1,001 до 1,030 г/мл. Нормальные почки здоро-
22
вого человека способны разводить и концентрировать мочу с минимальных значений 50-80 ммоль/кг, что соответствует относительной плотности 1,001-1,002 г/мл, до максимальных значений 1400 ммоль/л. Осмоляльность (или относительная плотность) наиболее высока в первой утренней порции мочи и составляет, как правило, более 700 ммоль/л (1,020 г/мл). Нормальный диапазон осмоляльности мочи составляет от 200 до 1000 ммоль/л (1,005-1,030 г/мл), но обычно осмоляльность мочи составляет 350-850 ммоль/л (относительная плотность 1,010-1,025 г/мл). Нормальный диапазон концентрирования мочи для пациентов при обычном потреблении воды и пищи от 550 до 850 ммоль/л (1,015-1,025 г/мл).
Изотонические растворы — растворы с одинаковым осмотическим давлением.
При контакте с изотоническим раствором осмотической ячейки, представляющей собой систему, отделѐнную от окружающей среды мембраной с избирательной проницаемостью, между ними происходит равновесный обмен растворителем. Все клетки живых организмов являются осмотическими ячейками. Раствор, который изотоничен плазме крови, называется физиологическим, например, 0,9%-ный раствор NaCI.
Гипертонический раствор — раствор, обладающий большим осмотическим давлением по сравнению с контактируемым раствором.
При контакте осмотической ячейки с гипертоническим раствором наблюдается экзосмос — движение растворителя из осмотической ячейки в окружающий еѐ гипертонический раствор. Наблюдаемое при этом явление называется плазмолизом.
Плазмолиз — сжатие и сморщивание клеток за счѐт экзосмоса в гипертоническом растворе.
При внутривенном введении больному гипертонического по отношению к плазме крови раствора происходит осмотический конфликт — обезвоживание и сморщивание клеток вследствие экзоосмоса. При резком плазмолизе клетки могут погибнуть.
Гипертонические растворы используют для промывания гнойных ран, в качестве слабительных препаратов (горькая соль MgSO4∙7H2O, глауберова соль Na2SO4∙10H2O), диуретиков.
Гипотонический раствор — раствор, обладающий меньшим осмотическим давлением по сравнению с контактируемым раствором.
При контакте осмотической ячейки с гипотоническим раствором происходит эндосмос — движение растворителя в осмотическую ячейку из окружающего еѐ гипотонического раствора, приводящее к набуханию клетки и даже ее разрыву.
Гемолиз — набухание и разрушение за счѐт эндосмоса клеточных мембран эритроцитов в гипотоническом растворе, приводящее к выделе-
23

нию гемоглобина в плазму (лаковая кровь). Разрушение клеток называют лизисом.
При внутривенном введении больному гипотонического по отношению к плазме крови раствора происходит осмотический «шок» — разрушение клеток вследствие эндосмоса. При разрушении эритроцитов гемоглобин попадает в плазму крови и не может выполнять свою основную функцию — транспорт кислорода, поэтому наступает гипоксия тканей.
Уменьшение осмотического давления за счет потери солевых компонентов может привести к рвоте, судорогам, потере сознания. В связи с этим, например, рабочие горячих цехов, у которых происходит сильное потоотделение, пьют подсоленную воду. Увеличение осмотического давления за счет избытка соли приводит к перераспределению жидкости в организме, которая скапливается в тканях, содержащих избыток соли, вызывая тем самым отѐк.
Изотонический | Гипертонический | Гипотонический | |
раствор | раствор | раствор | |
Вид спереди | |||
Вид в профиль | |||
Нормальные | Сморщиваюшиеся | Набухшие клетки | |
клетки (осмотичеклетки (зубчатые) | (гемолизирован- | ||
ское равновесие) | ные) | ||
Рис. 7. Действие осмотического давления на клетки
У животных, которые способны менять количество потребляемой воды в зависимости от обстоятельств, действует особая система осморегуляции. Например, осмолярность мочи бобра, не испытывающего дефицита воды, равна 0,6 осмоль/л, а у живущего в пустыне тушканчика — 9 осмоль/л. У пресноводных рыб тка
невые жидкости гипертоничны по отношению к пресной воде, поэтому такие рыбы накачивают воду путем осмоса через жаберные щели, выводя ее потом из организма с большим объемом разведенной мочи. Напротив, у морских рыб тканевые жидкости гипотоничны по отношению к морской воде, поэтому они через жаберные щели выделяют воду, а для ее компенсации пьют морскую воду. Моча, выделяемая такими рыбами, изотонична морской воде и объем ее очень мал.
24

При снижении осмотического давления крови до 400-350 кПа наступает гибель организма.
Онкотическое давление — осмотическое давление, создаваемое за счѐт наличия белков в биожидкостях организма. Оно составляет 0,5% от суммарного осмотического давления плазмы крови. В результате понижения онкотического давления при гипопротеинемии происходит перераспределение жидкости в сторону ткани и возникновение онкотических отѐков («голодных» или «почечных»).
Давление насыщенного пара растворителя над раствором
Давление насыщенного пара над растворителем (ро) — давление,
при котором при данной температуре в системе «жидкость-пар» наступает динамическое равновесие, характеризующееся равенством скоростей испарения и конденсации.
Давление насыщенного | Давление насыщенного |
пара растворителя | р0 > p пара растворителя |
Чистый растворитель | Раствор |
— частица растворителя; | — частица растворенного нелетучего вещества |
Рис. 8. Испарение чистого растворителя и испарение растворителя из раствора
Если в растворитель ввести нелетучий неэлектролит (рис. 8), то испарение молекул растворителя уменьшится вследствие:
уменьшения подвижности молекул растворителя за счѐт межмолекулярного и ион-дипольного взаимодействия растворитель-вещество;
уменьшения поверхности испарения, т.к. часть поверхности занята молекулами нелетучего вещества; уменьшения молярной доли растворителя и нарушения за счѐт этого
равновесия жидкость-пар. В соответствии с принципом Ле Шателье начинает протекать процесс, стремящийся ослабить влияние воздействия, т.е. конденсация, что и приводит к уменьшению количества пара, а, следовательно, и к снижению его давления над раствором по сравнению с растворителем.
25

Давление насыщенного пара растворителя над раствором
всегда меньше, чем над чистым растворителем.
Математически это выражается с помощью I закона Рауля.
I закон Рауля — относительное понижение давления насыщенного пара растворителя над раствором в сравнении с его давлением над растворителем, равно молярной доле растворенного вещества (N):
Р о | Р | N (Х ) ; | P | n (X) | , |
Р | о | P | n (X) n (р — ля) | ||
o |
где Ро — давление насыщенного пара над растворителем; Р — давление насыщенного пара над раствором;
n(X) и n(р-ля) — количество растворенного вещества и растворителя.
Для растворов электролитов в математическое выражение I закона Рауля вводится изотонический коэффициент:
Температуры кипения и кристаллизации растворов непосредственно связаны с давлением над ними насыщенного пара растворителя.
Повышение температуры кипения и понижение температуры кристаллизации раствора по сравнению с растворителем
Температура кипения жидкости — это температура, при которой давление еѐ паров становится равным внешнему атмосферному давлению.
Например, при давлении 101,3 кПа температура кипения воды равна 100оС, а в горах при пониженном атмосферном давлении соответственно будет и ниже температура еѐ кипения.
Понижение давления пара растворителя в результате растворения в нѐм нелетучего вещества приводит к увеличению скорости конденсации пара и, следовательно, к нарушению равновесия жидкость-пар. Для восстановления этого равновесия, т.е. для повышения давления насыщенного пара над раствором, необходимо повысить температуру, следовательно, температура кипения раствора будет выше температуры кипения растворителя.
Температура кристаллизации (замерзания) растворителя — это температура, при которой давление пара над жидкостью становится равным давлению пара над его твѐрдой фазой.
26

Растворение нелетучего вещества в растворителе приводит к уменьшению молярной доли растворителя и, соответственно, к нарушению равновесия жидкость-твѐрдая фаза. Для восстановления этого равновесия, т.е. для повышения молярной доли растворителя будет происходить плавление твѐрдой фазы, поэтому для кристаллизации раствора необходимо понизить температуру. Таким образом, температура кристаллизации раствора будет ниже температуры кристаллизации растворителя. При этом температуру кристаллизации следует фиксировать при выделении из раствора первого кристаллика твѐрдой фазы, т.к. при образовании большего количества твѐрдой фазы концентрация растворѐнного вещества будет возрастать и температура замерзания раствора будет понижаться.
Математически эти зависимости выражаются с помощью II закона Рауля.
II закон Рауля — повышение температуры кипения и понижение температуры кристаллизации раствора пропорционально моляльной концентрации сm(X) растворенного вещества:
Ткип = Е сm(X) | Ткрист = K сm(X), |
где Е, K — соответственно, эбулиоскопическая и криоскопическая постоянные, зависящие только от природы растворителя.
Математически Е = Ткип и K = Ткрист при сm(X) = 1 моль/кг. Однако, при такой концентрации растворенного вещества раствор нельзя считать
разбавленным, поэтому для нахождения этих величин строят график зависимости экспериментально измеренных Ткип и Ткрист от сm(X) и экстрапалируют полученную зависимость на ось ординат. Отсекаемые при этом отрезки и будут равны величинам Е и K. В приложении приведены значения Е и K для некоторых жидкостей.
Для растворов электролитов в математическое выражение II закона Рауля вводится изотонический коэффициент i:
Ткип = i Е сm(X) Ткрист = i K сm(X)
На измерении температур кипения и кристаллизации растворов основаны экспериментальные методы эбулиоскопия и криоскопия, которые применяются для определения молярных масс веществ, изотонического коэффициента, степени диссоциации слабых электролитов.
После подстановки в математическое выражение II закона Рауля формулы для расчета сm(X) и преобразования этого выражения получим формулы для расчета молярной массы:
27

M | E m (X ) | ; | M | K m (X ) | ||
Tкип | m (р ля ) | Tкрист | m (р ля ) | |||
где m(Х) — масса растворенного вещества, г; m(р-ля) — масса растворителя, кг.
Экспериментально измерив Ткип и Ткрист, можно рассчитать M(Х). На практике чаще используют криоскопический метод определения молярных масс. Особенно он удобен для изучения органических веществ: исследуемое вещество растворяют в бензоле и с помощью термометра Бекмана точно измеряют Тзам.
Рис. 9. Фазовые переходы
Высоко в горах при низком внешнем атмосферном давлении температура кипения воды может достигать только 60оС. При этой температуре не удается сварить мясо, поэтому у жителей высокогорных сѐл особый рацион питания.
Вы, наверное, замечали, что вода в кастрюле под закрытой крышкой быстрее закипает, а в кастрюле-скороварке быстрее готовится пища, так как благодаря ее особой конструкции, предусматривающей герметичность закрывания крышки, температура кипения воды достигает 104оС. В автоклавах, используемых для дезинфекции медицинского инструментария, температура кипения может достигать 250оС.
Типовые упражнения и задачи с решениями
Задача № 1
В закрытом сосуде находятся два стакана: с чистой водой и с раствором серной кислоты в воде. Какие процессы будут наблюдаться при этом?
Решение:
Согласно I закону Рауля давление насыщенного пара над чистой водой будет выше, чем над раствором, поэтому будет происходить диффузия
28
молекул воды в закрытом сосуде от стакана с чистой водой к стакану с раствором. Это приведѐт к нарушению равновесия и протеканию в результате этого следующих процессов:
а) давление насыщенного пара над чистой водой уменьшится, поэтому скорость испарения превысит скорость конденсации, что приведѐт к понижению уровня чистой воды в стакане и уменьшению еѐ температуры вследствие протекания эндотермического процесса испарения; б) давление насыщенного пара над раствором повысится, поэтому ско-
рость конденсации превысит скорость испарения, что приведѐт к повышению уровня раствора в стакане, понижению концентрации растворѐнного вещества и повышению температуры вследствие протекания экзотермического процесса растворения серной кислоты в воде. Понижение концентрации вызовет, в свою очередь, постепенное уменьшение давления насыщенного пара над раствором и, соответственно, уменьшение скорости диффузии молекул воды в закрытом сосуде.
Задача № 2
Почему для чистой воды мы говорим «температура плавления», а для раствора — «температура начала кристаллизации» или «температура появления первых кристаллов»?
Решение:
Для чистой воды температура фазового перехода вода-лѐд остаѐтся неизменной в течение всего процесса. Согласно II закону Рауля температура кристаллизации раствора будет ниже, чем у растворителя, поэтому при понижении температуры будут образовываться кристаллы растворителя, что приведѐт к постепенному увеличению концентрации растворѐнного вещества и, соответственно, к дальнейшему постепенному понижению температуры кристаллизации. В связи с этим температуру замерзания растворов следует фиксировать при появлении первых кристаллов льда, т.к. это практически будет соответствовать первоначальной концентрации раствора.
Задача № 3
Вбольшом сосуде кипит вода; в этот сосуд поместили другой сосуд также с водой. Закипит ли в нѐм вода? В большой сосуд добавили некоторое количество хлорида натрия. Что произойдѐт в малом сосуде?
Решение:
Впервом случае температура кипения воды будет неизменной, т.к. подводимая к ней теплота затрачивается на эндотермический процесс еѐ испарения, поэтому вода в другом, помещѐнном в неѐ сосуде не закипит. В результате добавления в большой сосуд хлорида натрия температура кипения раствора согласно II закону Рауля увеличится и станет выше темпера-
29
Источник