Какие продукты взаимодействия натрия с водой
Содержание статьи
Секреты реакции металлического натрия с водой
Самой интересной на школьных уроках химии была тема о свойствах активных металлов. Нам не только подавали теоретический материал, но и демонстрировали интересные эксперименты. Наверное, все помнят, как учитель бросал в воду маленький кусочек металла, а он метался по поверхности жидкости и воспламенялся. В этой статье мы разберемся, как происходит реакция натрия и воды, почему металл взрывается.
Свойства натрия
Металлический натрий – это серебристое вещество, по плотности напоминающее мыло или парафин. Натрий характеризуется хорошей тепло- и электропроводностью. Именно поэтому его используют в промышленности, в частности для изготовления аккумуляторов.
Натрий обладает высокой химической активностью. Часто реакции проходят с выделением большого количества тепла. Иногда это сопровождается воспламенением или взрывом. Работа с активными металлами требует хорошей информационной подготовки и опыта. Хранить натрий можно только в хорошо закрытых тарах под слоем масла, так как на воздухе металл быстро окисляется.
Самой популярной реакцией натрия является его взаимодействие с водой. В ходе реакции натрий плюс вода образуется щелочь и водород:
2Na + 2H2O = 2NaOH + H2 ↑
Водород окисляется кислородом из воздуха и взрывается, что мы и наблюдали в ходе школьного эксперимента.
Исследования реакции учеными из Чехии
Реакция натрия с водой очень проста для понимания: взаимодействие веществ приводит к образованию газа H2, который, в свою очередь, окисляется с помощью О2, находящегося в воздухе, и воспламеняется. Кажется, все просто. Но профессор Павел Юнгвирт из Академии наук Чехии так не считал.
Дело в том, что в процессе реакции образуется не только водород, но и пары воды, так как выделяется большое количество энергии, вода нагревается и испаряется. Так как натрий имеет низкую плотность, паровая подушка должна выталкивать его вверх, изолируя от воды. Реакция должна затухать, но этого не происходит.
Юнгвирт решил подробно изучить этот процесс и снял эксперимент на высокоскоростную камеру. Процесс снимался со скоростью 10 тыс. кадров в секунду и просматривался с 400-кратным замедлением. Ученые заметили, что металл, попадая в жидкость, начинает выпускать отростки в виде шипов. Объясняется это следующим образом:
- Щелочные металлы, попав в воду, начинают выступать в роли донора электронов и отдают негативно заряженные частицы.
- Кусочек металла обретает положительный заряд.
- Положительно заряженные протоны начинают отталкиваться друг от друга, образуя металлический отростки.
- Отростки-шипы прокалывают паровую подушку, поверхность контакта реагирующих веществ увеличивается, и реакция усиливается.
Как провести эксперимент
Кроме водорода, в ходе реакции воды и натрия образуется щелочь. Чтобы это проверить, можно использовать любой индикатор: лакмус, фенолфталеин или метилоранж. Легче всего будет работать с фенолфталеином, так как он бесцветный в нейтральной среде и реакцию будет легче наблюдать.
Чтобы провести эксперимент нужно:
- Налить в кристаллизатор дистиллированную воду, чтобы она занимала больше половины объема посудины.
- Добавить в жидкость несколько капель индикатора.
- Отрезать кусочек натрия, размером с полгорошины. Для этого используют скальпель или тонкий нож. Резать металл нужно в таре, не винимая натрий из масла, чтобы избежать окисления.
- Достать кусочек натрия из банки пинцетом и промокнуть фильтровальной бумагой, чтобы очистить от масла.
- Бросить натрий в воду и наблюдать за процессом с безопасного расстояния.
Все инструменты, используемые в эксперименте, должны быть чистыми и сухими.
Вы увидите, что натрий не погружается в воду, а остается на поверхности, что объясняется плотностью веществ. Натрий начнет реагировать с водой, выделяя тепло. От этого металл расплавится и превратится в капельку. Эта капелька начнет активно двигаться по воде, издавая характерное шипение. Если кусочек натрия был не слишком маленьким, он загорится желтым пламенем. Если кусочек был слишком большим, может произойти взрыв.
Также вода поменяет свой цвет. Это объясняется выделением щелочи в воду и окрашиванием растворенного в ней индикатора. Фенолфталеин станет розовым, лакмус синим, а метилоранж – желтым.
Это опасно
Взаимодействие натрия с водой очень опасно. В ходе эксперимента можно получить серьезные травмы. Гидроксид, пероксид и оксид натрия, которые образуются в ходе реакции, могут разъедать кожу. Щелочь, разбрызгиваясь, может попасть в глаза и привести к серьезным ожогам и даже слепоте.
Поэтому мы не рекомендуем вам самостоятельно проводить исследование.
Манипуляции с активными металлами должны проводиться в химических лабораториях под наблюдением лаборанта, который имеет опыт работы с щелочными металлами.
Также нужно придерживаться следующих рекомендаций:
- Работать исключительно в защитных очках.
- Ни в коем случае не наклоняться над посудиной, когда металл находится на воде.
- Отходить от кристаллизатора на несколько метров сразу после того, как металл будет брошен в воду.
- Быть всегда наготове, так как взрыв может произойти в любой момент.
- Не подходить к катализатору, пока не убедитесь, что реакция закончилась.
Свойства металлического натрия: Видео
Источник
Безопасность парогенераторов натрий-вода — Кинетика и термодинамика химического взаимодействия натрия с водой
Страница 5 из 24
Глава 2
ОБЩИЕ СВЕДЕНИЯ О ВЗАИМОДЕЙСТВИИ НАТРИЯ С ВОДОЙ
Кинетика и термодинамика химического взаимодействия натрия с водой
Химическое взаимодействие натрия и воды протекает в два этапа. На первом этапе реакция протекает с большой скоростью с выделением газообразного водорода и тепла:
(2.1)
Обратить эту реакцию практически невозможно, так как равновесное давление водорода очень велико. На втором этапе происходит химическое взаимодействие продуктов первого этапа реакции с избыточным натрием (избыток натрия характерен при течах воды в условиях парогенератора с натриевым теплоносителем):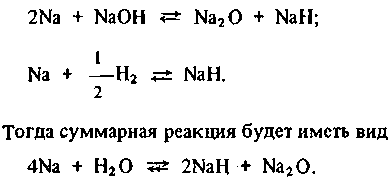
(2.2)
(2.3)
(2.4)
Таким образом, взаимодействие натрия с водой — довольно сложный, многоэтапный процесс, в котором протекают последовательные реакции образования гидроксида натрия и водорода и их последующее взаимодействие с натрием. Конечная концентрация продуктов взаимодействия воды с натрием определяется условиями термодинамического равновесия, а время достижения равновесного состояния — кинетикой протекающих реакций.
Реакция натрия с водой в конденсированном состоянии протекает с очень высокой скоростью (практически мгновенно) . Однако весьма важно, что образующийся газообразный водород разъединяет реагирующие компоненты, в результате чего реальная скорость взаимодействия натрия с водой определяется перемешиванием реагентов и не носит взрывного характера. Бытующее мнение о взрывном характере взаимодействия воды с натрием связано с возможностью взрывного взаимодействия смеси водорода с газообразным кислородом, образование которой происходит при выделении образующегося водорода в среду, содержащую газообразный кислород. Инициатором взрыва такой смеси могут служить высокие температуры, которые развиваются в зоне реакции.
Многочисленными исследованиями показано, что изоляция системы натрий—вода от кислорода созданием над уровнем воды или натрия газовой полости с бескислородной атмосферой (аргон, гелий, азот) полностью исключает взрывные эффекты. Одновременно такая газовая полость служит эффективным демпфером для расширения образующегося водорода. Это исключает быстрое и значительное нагружение конструкции.
Состояние продуктов взаимодействия натрия с водой при термодинамическом равновесии. Данные по состоянию продуктов реакции натрия с водой получены как использованием расчетных методов, так и анализом проб, отобранных при проведении опытов по взаимодействию воды с натрием.
Методика термодинамических расчетов основана на решении системы уравнений, получающихся с использованием закона действующих масс для независимых реакций, протекающих в данной системе, и балансных уравнений по компонентам, участвующим в реакциях.
Основная сложность связана с выбором исходных термодинамических данных, в особенности данных по переходу от термодинамической активности к концентрациям.
При проведении расчетов считается, что реакция (2.1) идет до конца, количество натрия в системе превышает количество воды, попавшей в нее, т.е. n0Na>>nH2O, и все продукты взаимодействия находятся в натрии в растворенном состоянии, количеством водорода, находящимся в газовой фазе, можно пренебречь.
Тогда равновесные концентрации продуктов реакции находятся из системы уравнений:
первое из которых — следствие закона действующих масс, а три последних — балансные уравнения для кислорода, водорода и натрия, причем
К2.2=ехр(-ΔΖ°(2. 2)/RT).
Решение системы уравнений (2.5)-(2.8) дает: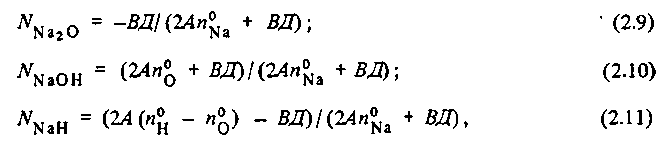
где
Расчет по (2.9) — (2.11) показывает, что с ростом температуры с 300 до 500 суменьшается с 0,17 до 0,007, а с ростом
доля водорода в виде гидроксида также растет. Последнее должно приводить к тому, что равновесное давление водорода над натрием, содержащим кислород и водород, будет понижаться с ростомЭто
подтверждено специальными опытами [15].
При попадании значительного количества воды в натрий указанное выше условиене выполняется. При этом концентрация
образующихся соединений может превысить их растворимость в натрии. В этих условиях образуется каустическая фаза, состоящая из гидроксида и растворенных в нем оксида, гидрида натрия и натрия. Термодинамический анализ состава каустической фазы при допущении, что растворимость натрия в гидроксиде мала по сравнению с растворимостью гидрида и оксида [77, 76], т.е. в каустической фазе
NNa=0, показал, что основными продуктами реакции в присутствии жидкого натрия как самостоятельной фазы будут гидроксид, гидрид и оксид натрия, молярные доли которых при 450 °C и≈ 0,5 равны 0,46; 0,51;
0,03 соответственно. С ростом температуры и nдоля гидроксида растет. При этом важно, что температура плавления каустической фазы, формирующейся в таких условиях, будет превышать температуру плавления чистого гидроксида.
В реальных условиях формирования каустической фазы температура ее плавления не превышала 400 °C. В открытой системе, когда возможна потеря водорода, температура плавления каустической фазы по мере обеднения ее водородом будет расти.
Общие закономерности, описывающие равновесное давление водорода в газовой фазе над системой натрий-кислород-водород, в настоящее время неизвестны.
Растворимость в натрии, млн-1, кислорода, водорода, а также продуктов взаимодействия натрия с водой описывается уравнениями:
В (2.19) растворимость продуктов взаимодействия натрия с водой условно рассчитана на кислород, содержащийся в воде. Сопоставление (2.17) и (2.19) показывает, что растворимость кислорода в присутствии водорода увеличивается.
На рис. 2.1 представлена диаграмма равновесных состояний системы натрий-вода в зависимости от температуры и молярной доли воды в составе реагентов [19].
Конечными продуктами реакции натрия с водой могут быть гидрид и оксид натрия в жидких растворах на основе натрия и его гидроксида, гидрид и твердый раствор гидроксида, а также водный раствор щелочи и газообразный водород.
36 Изменение концентрации продуктов взаимодействия натрия с водой в натрии и защитном газе с учетом кинетики реакций. Будем считать, что течь воды в натрий постоянна во времени. Из полного количества газообразного водорода, образующегося при взаимодействии натрия с водой, доля его, равная (1-а), находится в натрии, а остальной водород поступает в защитный газ. 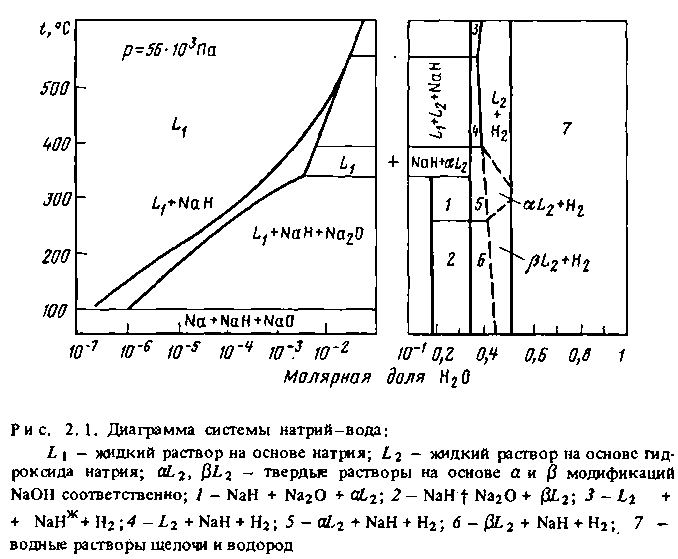
Тогда, принимая, что водород взаимодействует с натрием на поверхности раздела по реакции первого порядка, а выделение его из натрия за счет обратной реакции происходит по реакции второго порядка, а реакция гидроксида натрия с натрием гомогенна и первого порядка, и считая, что перемешивание в контуре и газовой фазе идеальное, получаем уравнения баланса:
для водорода в газе
Считая, что сферический пузырь, находящийся в движущемся вверх натрии, взаимодействует с натрием кинетически, причем скорость образования гидрида много выше скорости обратной реакции, а температура и давление водорода в пузыре равны соответствующим параметрам натрия, запишем уравнение, описывающее изменение диаметра пузыря:
(2.34) где х — расстояние до места течи; Т и р- температура и давление в точке х соответственно; f (х) определяется из (2.27) [с учетом вида функции T(х) ]. Решения уравнения (2.34) для случаев wn = const и
wn > wNa, когда d = d0 при х = 0, имеют вид:
в первом случае
Используя (2.35) —(2.37), можно определить расстояние, пройдя которое пузырь с начальным диаметром d0 полностью растворится, т.е. а станет равным нулю.
Из приведенных выражений видно, что доля водорода, выходящего в газовую полость, зависит от многих параметров: направления движения натрия в парогенераторе, температуры, давления, начального диаметра пузыря и др.
Водородные пузыри уносятся из парогенератора с потоком натрия. Сложность гидродинамики потока в парогенераторах и контурах не позволяет провести точную аналитическую оценку доли пузырей, выходящих в газовую полость. Однако очевидно, что чем ближе место течи к газовой полости, тем эта доля должна быть больше.
Полученные уравнения позволяют рассчитать изменение концентрации примесей в контуре во времени и оценить эффективность различных систем обнаружения течи воды в натрий.
Источник
Интересные факты про взаимодействие металлического натрия с водой
Помните самые интересные уроки химии в школе, когда проходили тему характеристик активных металлов? Штудировали не только учебники, но и ставили опыты. Многие из нас вспомнят такой эксперимент, когда учитель погружал в колбу с обыкновенной водой металлический кусочек и… металл, вдруг, начинал метаться по емкости и гореть. Так мы познакомились с удивительными свойствами натрия. В этой статье вспомним, почему происходит реакция воспламенения этого металла в воде…
Характеристики натрия
Металлический натрий представляет собой твердое вещество серебристого цвета, плотность которого сопоставима с плотностью парафина или мыла. Этот металл обладает высокой электрической и теплопроводностью. Основное применение в промышленной сфере — производство аккумуляторов.
Самой значимой реакцией металлического натрия ученые считают его взаимодействие с обычной водой, так как после неё образуются водород и щелочь. Соответственно взрывается и воспламеняется в соединении именно водород H2.
Изучение реакции натрия с водой чешскими учеными
Сама по себе данная реакция проста для понимания: вещества взаимодействуют друг с другом, в результате чего образуется газ — водород. Он окисляется кислородом, который находится в воздухе, и воспламеняется. Однако чешский ученый Павел Юнгвирт считал несколько иначе.
Во-первых, в процессе взаимодействия образуются также водяные пары, которые испаряются вместе с водородом. Во-вторых, натрий имеет меньшую плотность, чем паровая прослойка и должен выталкиваться наружу. Реакция должна сходить на нет, но происходит все в точности наоборот.
Ученый решил подробно рассмотреть реакцию при помощи специальной видеокамеры. Запись велась со скоростью около 10 000 кадров в секунду, а просматривалась пленка с замедлением в 400 раз. Таким образом, ученые определили интересный факт. Активные металлы, в частности натрий, в воде начинают распускать во все стороны отростки-шипы.
Это происходит по следующим причинам:
- Щелочные металлы в воде отдают негативно заряженные ионы.
- Сам металл получает положительный заряд.
- Протоны начинают отталкиваться друг от друга, таким образом, выпуская отростки.
- Отростки пробивают паровую прослойку, и натрий вступает в известную нам реакцию с водой.
Экспериментируем с натрием
В процессе взаимодействия натрия с водой образуется также щелочь. Проверить это можно с помощью лакмусовой бумаги или фенолфталеина.
Для опыта нужно:
- Наполнить емкость дистиллированной водой больше половины
- Добавить в жидкость 2-3 капли фенолфталеина.
- Поместить в емкость кусочек металлического натрия и наблюдать за процессом, расположившись на безопасном расстоянии.
Натрий не опускается на дно пробирки, а остается на поверхности воды. Далее он начинает плавиться и выделять тепло. Оставшаяся капелька начнет быстро двигаться по емкости и шипеть. Последний этап реакции — воспламенение желтым огнем или небольшой взрыв. Вода при этом меняет цвет из-за выброса щелочи. Фенолфталеин — индикатор окрасит жидкость в розовый цвет.
Техника безопасности при экспериментах с натрием
Проводить манипуляции с активными металлами следует в специальных лабораториях и обязательно придерживаясь правил безопасности:
- Работать в защитных очках и перчатках.
- Не наклоняться над пробиркой, когда металл уже находится в воде.
- При старте реакции отходить от емкости на несколько метров.
- Быть начеку, так как взрыв может случиться в любой момент.
- Не подходить к емкости с металлом до полного окончания реакции.
Уважаемые читатели!
Спасибо, что читаете наш блог! Получайте самые интересные публикации раз в месяц оформив подписку. Новым читателям предлагаем попробовать нашу воду бесплатно, при первом заказе выберите 12 бутылок (2 упаковки) минеральной воды BioVita или питьевой воды Stelmas. Операторы свяжутся с Вами и уточнят детали. Тел. 8 (800) 100-15-15
* Акция для Москвы, МО, Санкт-петербурга, ЛО
Получи самые интересные публикации
Вы можете отписаться в любой момент
Спасибо за подписку на нашу рассылку
Источник