Какие продукты образуется при гликолизе
ГЛИКОЛИЗ
Гликолиз (от греч. glycys — сладкий и lysis — растворение, распад) — это последовательность ферментативных реакций, приводящих к превращению глюкозы в пируват с одновременным образованием АТФ.
При аэробных условиях пируват проникает в митохондрии, где полностью окисляется до СО2 и Н2О. Если содержание кислорода недостаточно, как это может иметь место в активно сокращающейся мышце, пируват превращается в лактат.
Итак, гликолиз — не только главный путь утилизации глюкозы в клетках, но и уникальный путь, поскольку он может использовать кислород, если
последний доступен (аэробные условия), но может протекать и в отсутствие кислорода (анаэробные условия).
Анаэробный гликолиз — сложный ферментативный процесс распада глюкозы, протекающий в тканях человека и животных без потребления кислорода. Конечным продуктом гликолиза является молочная кислота. В процессе гликолиза образуется АТФ. Суммарное уравнение гликолиза можно представить следующим образом:
В анаэробных условиях гликолиз — единственный процесс в животном организме, поставляющий энергию. Именно благодаря гликолизу организм человека и животных определенный период может осуществлять ряд физиологических функций в условиях недостаточности кислорода. В тех случаях, когда гликолиз протекает в присутствии кислорода, говорят об аэробном гликолизе .
Последовательность реакций анаэробного гликолиза, так же как и их промежуточные продукты, хорошо изучена. Процесс гликолиза катализируется одиннадцатью ферментами, большинство из которых выделено в гомогенном, клисталлическом или высокоочищенном виде и свойства которых достаточно известны. Заметим, что гликолиз протекает в гиало-плазме (цитозоле) клетки.
Первой ферментативной реакцией гликолиза является фосфорилирование, т.е. перенос остатка ортофосфата на глюкозу за счет АТФ. Реакция катализируется ферментом гексокиназой:
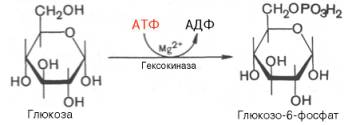
Образование глюкозо-6-фосфата в гексокиназной реакции сопровождается освобождением значительного количества свободной энергии системы и может считаться практически необратимым процессом.
Наиболее важным свойством гексокиназы является ее ингибирование глюкозо-6-фосфатом, т.е. последний служит одновременно и продуктом реакции, и аллостерическим ингибитором.
Фермент гексокиназа способен катализировать фосфорилирование не только D-глюкозы, но и других гексоз, в частности D-фруктозы, D-маннозы и т.д. В печени, кроме гексокиназы, существует фермент глюкокиназа, который катализирует фосфорилирование только D-глюкозы. В мышечной ткани этот фермент отсутствует (подробнее см. главу 16).
Второй реакцией гликолиза является превращение глюкозо-6-фос-фата под действием фермента глюкозо-6-фосфатизомеразы во фруктозо-6-фосфат:
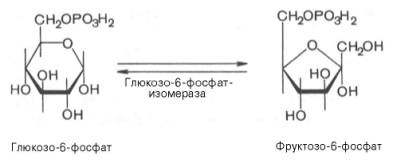
Эта реакция протекает легко в обоих направлениях, и для нее не требуется каких-либо кофакторов.
Третья реакция катализируется ферментом фосфофруктокиназой; образовавшийся фруктозо-6-фосфат вновь фосфорилируется за счет второй молекулы АТФ:
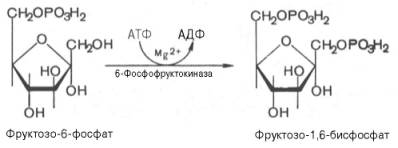
Данная реакция аналогично гексокиназной практически необратима, протекает в присутствии ионов магния и является наиболее медленно текущей реакцией гликолиза. Фактически эта реакция определяет скорость гликолиза в целом.
Фосфофруктокиназа относится к числу аллостерических ферментов. Она ингибируется АТФ и стимулируется АМФ . При значительных величинах отношения АТФ/АМФ активность фосфофруктокиназы угнетается и гликолиз замедляется. Напротив, при снижении этого коэффициента интенсивность гликолиза повышается. Так, в неработающей мышце активность фосфофруктокиназы низкая, а концентрация АТФ относительно высокая. Во время работы мышцы происходит интенсивное потребление АТФ и активность фосфофруктокиназы повышается, что приводит к усилению процесса гликолиза.
Четвертую реакцию гликолиза катализирует фермент альдолаза. Под влиянием этого фермента фруктозо-1,6-бисфосфат расщепляется на две фосфотриозы:
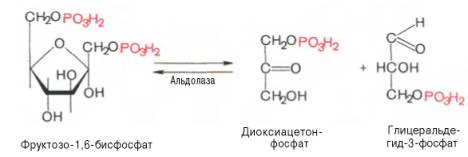
Эта реакция обратима. В зависимости от температуры равновесие устанавливается на различном уровне. При повышении температуры реакция сдвигается в сторону большего образования триозофосфатов (дигидро-ксиацетонфосфата и глицеральдегид-3-фосфата).
Пятая реакция — это реакция изомеризации триозофосфатов. Катализируется ферментом триозофосфатизомеразой:

Равновесие данной изомеразной реакции сдвинуто в сторону дигид-роксиацетонфосфата: 95% дигидроксиацетонфосфата и около 5% глице-ральдегид-3-фосфата. В последующие реакции гликолиза может непосредственно включаться только один из двух образующихся триозофосфатов, а именно глицеральдегид-3-фосфат. Вследствие этого по мере потребления в ходе дальнейших превращений альдегидной формы фосфотриозы ди-гидроксиацетонфосфат превращается в глицеральдегид-3-фосфат.
Образованием глицеральдегид-3-фосфата как бы завершается первая стадия гликолиза. Вторая стадия — наиболее сложная и важная. Она включает окислительно-восстановительную реакцию (реакция гликолитической оксидоредукции), сопряженную с субстратным фосфорилированием, в процессе которого образуется АТФ.
В результате шестой реакции глицеральдегид-3-фосфат в присутствии фермента глицеральдегидфосфатдегидрогеназы, кофермента НАД и неорганического фосфата подвергается своеобразному окислению с образованием 1,3-бисфосфоглицериновой кислоты и восстановленной формы НАД (НАДН). Эта реакция блокируется йод- или бромацетатом, протекает в несколько этапов:
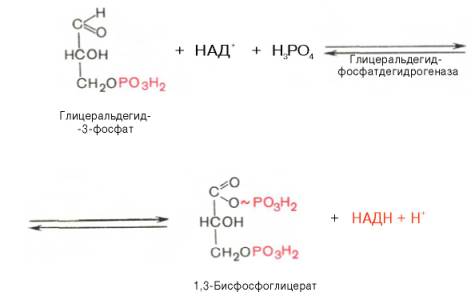
1,3-Бисфосфоглицерат представляет собой высокоэнергетическое соединение (макроэргическая связь условно обозначена знаком «тильда» ~). Механизм действия глицеральдегидфосфатдегидрогеназы сводится к следующему: в присутствии неорганического фосфата НАД+ выступает как акцептор водорода, отщепляющегося от глицеральдегид-3-фосфата. В процессе образования НАДН глицеральдегид-3-фосфат связывается с молекулой фермента за счет SH-групп последнего. Образовавшаяся связь богата энергией, но она непрочная и расщепляется под влиянием неорганического фосфата, при этом образуется 1,3-бисфосфоглицериновая кислота.
Седьмая реакция катализируется фосфоглицераткиназой, при этом происходит передача богатого энергией фосфатного остатка (фосфатной группы в положении 1) на АДФ с образованием АТФ и 3-фосфогли-цериновой кислоты (3-фосфоглицерат):
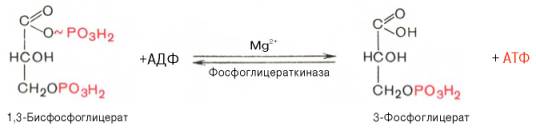
Таким образом, благодаря действию двух ферментов (глицеральде-гидфосфатдегидрогеназы и фосфоглицераткиназы) энергия, высвобождающаяся при окислении альдегидной группы глицеральдегид-3-фосфата до карбоксильной группы, запасается в форме энергии АТФ. В отличие от окислительного фосфорилирования образование АТФ из высокоэнергетических соединений называется субстратным фосфорилированием.
Восьмая реакция сопровождается внутримолекулярным переносом оставшейся фосфатной группы, и 3-фосфоглицериновая кислота превращается в 2-фосфоглицериновую кислоту (2-фосфоглицерат).
Реакция легкообратима, протекает в присутствии ионов Mg2+. Кофактором фермента является также 2,3-бисфосфоглицериновая кислота аналогично тому, как в фосфоглюкомутазной реакции роль кофактора выполняет глюкозо-1,6-бисфосфат:

Девятая реакция катализируется ферментом енолазой, при этом 2-фосфоглицериновая кислота в результате отщепления молекулы воды переходит в фосфоенолпировиноградную кислоту (фосфоенолпируват), а фосфатная связь в положении 2 становится высокоэргической:
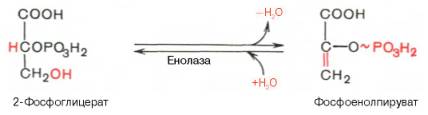
Енолаза активируется двухвалентными катионами Mg2+или Мn2+ и ингибируется фторидом.
Десятая реакция характеризуется разрывом высокоэргической связи и переносом фосфатного остатка от фосфоенолпирувата на АДФ (субстратное фосфорилирование). Катализируется ферментом пируваткиназой:
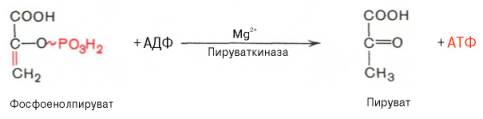
Для действия пируваткиназы необходимы ионы Mg2+, а также одновалентные катионы щелочных металлов (К+ или др.). Внутри клетки реакция является практически необратимой.
В результате одиннадцатой реакции происходит восстановление пировиноградной кислоты и образуется молочная кислота. Реакция протекает при участии фермента лактатдегидрогеназы и кофермента НАДН, образовавшегося в шестой реакции:

Последовательность протекающих при гликолизе реакций представлена на рис. 10.3.
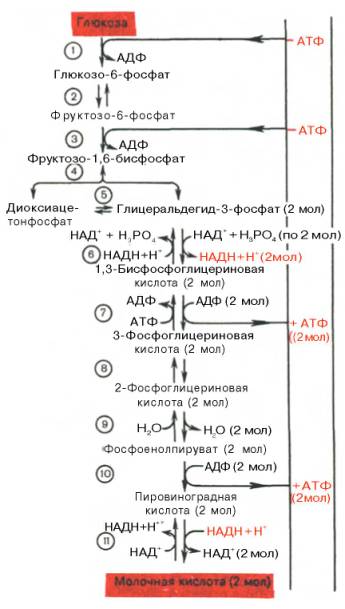
Рис. 10.3. Последовательность реакций гликолиза.
1 — гексокиназа; 2 — фосфоглюкоизоме-раза; 3 — фосфофруктокиназа; 4 — альдо-лаза; 5 — триозофосфатизомераза; 6 — гли-церальдегидфосфатдегидрогеназа; 7 -фосфоглицераткиназа; 8 — фосфоглицеромутаза; 9 — енолаза; 10 — пируватки-наза; 11 — лактатдегидрогеназа.
Реакция восстановления пирувата завершает внутренний окислительно-восстановительный цикл гликолиза. НАД+ при этом играет роль промежуточного переносчика водорода от глицеральдегид-3-фосфата (6-я реакция) на пировиноградную кислоту (11-я реакция), при этом сам он регенерируется и вновь может участвовать в циклическом процессе, получившем название гликолитический оксидоредукции.
Биологическое значение процесса гликолиза заключается прежде всего в образовании богатых энергией фосфорных соединений. На первых стадиях гликолиза затрачиваются 2 молекулы АТФ (гексокиназная и фосфофрук-токиназная реакции). На последующих образуются 4 молекулы АТФ (фосфоглицераткиназная и пируваткиназная реакции). Таким образом, энергетическая эффективность гликолиза в анаэробных условиях составляет 2 молекулы АТФ на одну молекулу глюкозы.
Как отмечалось, основной реакцией, лимитирующей скорость гликолиза, является фосфофруктокиназная. Вторая реакция, лимитирующая скорость и регулирующая гликолиз — гексокиназная реакция. Кроме того, контроль гликолиза осуществляется также ЛДГ и ее изоферментами.
В тканях с аэробным метаболизмом (ткани сердца, почек и др.) преобладают изоферменты ЛДГ1 и ЛДГ2 (см. главу 4). Эти изоферменты инги-бируются даже небольшими концентрациями пирувата, что препятствует образованию молочной кислоты и способствует более полному окислению пирувата (точнее, ацетил-КоА) в цикле трикарбоновых кислот.
В тканях человека, в значительной степени использующих энергию гликолиза (например, скелетные мышцы), главными изоферментами являются ЛДГ5 и ЛДГ4. Активность ЛДГ5 максимальна при тех концентрациях пирувата, которые ингибируют ЛДГ1. Преобладание изоферментов ЛДГ4 и ЛДГ5 обусловливает интенсивный анаэробный гликолиз с быстрым превращением пирувата в молочную кислоту.
Как отмечалось, процесс анаэробного распада гликогена получил название гликогенолиза. Вовлечение D-глюкозных единиц гликогена в процесс гликолиза происходит при участии 2 ферментов — фосфорилазы а и фосфо-глюкомутазы. Образовавшийся в результате фосфоглюкомутазной реакции глюкозо-6-фосфат может включаться в процесс гликолиза. После образования глюкозо-6-фосфата дальнейшие пути гликолиза и гликогенолиза полностью совпадают:
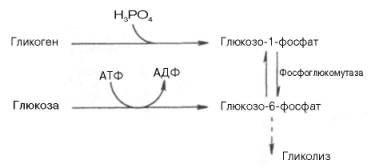
В процессе гликогенолиза в виде макроэргических соединений накапливаются не две, а три молекулы АТФ (АТФ не тратится на образование глюкозо-6-фосфата). Кажется, что энергетическая эффективность глико-генолиза выглядит несколько более высокой по сравнению с процессом гликолиза, но эта эффективность реализуется только при наличии активной фосфорилазы а. Следует иметь в виду, что в процессе активации фосфо-рилазы b расходуется АТФ (см. рис. 10.2).
Еще по теме:
- ГЛИКОЛИЗ — химическая энциклопедия
- Гликолиз — биохимический справочник
- Гликолиз — Наглядная биохимия
Источник
ГЛИКОЛИЗ
ГЛИКОЛИЗ (от греч. glykys — сладкий и lysis — распад, разложение) — один из трех основных (гликолиз, цикл Кребса и путь Энтнера — Дудорова) способов выработки энергии в живых организмах. Это процесс анаэробного (т.е. не требующего участия свободного О2) ферментативного негидролитического расщепления углеводов (главным образом глюкозы и гликогена) в животных тканях, сопровождающийся синтезом аденозинтрифосфорной кислоты (АТФ) и заканчивающийся образованием молочной кислоты. Гликолиз важен для мышечных клеток, сперматозоидов, растущих тканей (в том числе, опухолевых), т.к. обеспечивает накопление энергии в отсутствие кислорода. Но известен и гликолиз в присутствии О2 (аэробный гликолиз) — в эритроцитах, сетчатке глаза, тканях плода сразу после рождения и в слизистой оболочке кишечника. В изучение гликолиза большой вклад внесли Г. и К.Кори, а также такие пионеры биохимии как О.Мейерхоф и Г.Эмбден. Гликолиз был первой до конца расшифрованной последовательностью биохимических реакций (с конца 19 в. по 1940-е). Гексозомонофосфатный шунт или пентозофосфатный путь в некоторых клетках (эритроциты, жировая ткань) также может играть роль поставщика энергии.
Кроме глюкозы, в процесс гликолиза могут вовлекаться глицерин, некоторые аминокислоты и др. субстраты. В мышечной ткани, где основной субстрат гликолиза — гликоген, процесс начинается с реакций 2 и 3 (см. схему) и носит название гликогенолиза. Общим промежуточным продуктом для гликогенолиза и гликолиза является глюкозо-6-фосфат. Обратный путь образования гликогена называется гликогенезом.
Продукты, образующиеся при гликолизе, являются субстратами последующих окислительных превращений (см. Трикарбоновых кислот цикл или цикл Кребса). Процессами, аналогичными гликолизу, являются молочнокислое, маслянокислое, спиртовое, глицериновое брожение, протекающее в растительных, дрожжевых и бактериальных клетках. Интенсивность отдельных стадий гликолиза зависит от кислотности — водородного показателя — рН (оптимум рН 7-8), температуры и ионного состава среды. Последовательность реакций гликолиза (см. схему) хорошо изучена и промежуточные продукты идентифицированы. Растворимые ферменты гликолиза, присутствующие в клеточном соке, выделены в кристаллическом или очищенном виде.
Ферменты, осуществляющие отдельные этапы гликолиза:
1. Гексокиназа КФ2.7.1.1 (или глюкокиназа КФ2.7.1.2)
2. Гликогенфосфорилаза КФ2.4.1.1
3. Фосфоглюкомутаза КФ2.7.5.1
4. Глюкозофосфатизомераза КФ5.3.1.9
5. Фосфофруктокиназа КФ2.7.1.11
6. Фруктозобисфосфатальдолаза КФ4.1.2.13
7. Триозофосфатизомераза КФ5.3.1.1
8, 9. Глицеральдегидфосфатдегидрогеназа КФ1.2.1.12
10. Фосфоглицераткиназа КФ2.7.2.3
11. Фосфоглицеромутаза КФ2.7.5.3
12. Енолаза КФ4.2.1.11
13. Пируваткиназа КФ2.7.1.40
14. Лактатдегидрогеназа КФ1.1.1.27
Гликолиз начинается с образования фосфорных производных сахаров, что способствует превращению циклической формы субстрата в ациклическую, более реакционноспособную. Одной из реакций, регулирующих скорость гликолиза, является реакция 2, катализируемая ферментом фосфорилазой. Центральная регуляторная роль в гликолизе принадлежит ферменту фосфофруктокиназе (реакция 5), активность которой тормозится АТФ и цитратом, но стимулируется продуктами ее распада. Центральным звеном гликолиза является гликолитическая оксидоредукция (реакции 8-10), представляющая собой окислительно-восстановительный процесс, протекающий с окислением 3-фосфоглицеринового альдегида до 3-фосфоглицериновой кислоты и восстановлением кофермента никотинамидадениндинуклеотида (НАД). Эти превращения осуществляет дегидрогеназа 3-фосфоглицеринового альдегида (ДФГА) при участии фосфоглицераткиназы. Это — единственный окислительный этап в гликолизе, но и он не требует свободного кислорода, необходимо лишь присутствие НАД+, который при этом восстанавливается до НАД-Н2.
В результате оксидоредукции (окислительно-восстановительный процесс) высвобождается энергия, аккумулирующаяся (в виде богатого энергией соединения АТФ) в процессе субстратного фосфорилирования. Второй реакцией, обеспечивающей образование АТФ, является реакция 13 — образование пировиноградной кислоты. В анаэробных условиях гликолиз кончается образованием молочной кислоты (реакция 14) под действием лактатдегидрогеназы и с участием восстановленного НАД, который при этом окисляется до НАД (НАД-Н2) и вновь может быть использован на окислительном этапе. В аэробных условиях пировиноградная кислота окисляется в митохондриях в ходе цикла Кребса.
Т.о., при расщеплении 1 молекулы глюкозы образуются 2 молекулы молочной кислоты и 4 молекулы АТФ. В то же время на первых стадиях гликолиза (см. реакции 1, 5) затрачиваются 2 молекулы АТФ на 1 молекулу глюкозы. В процессе гликогенолиза образуется 3 молекулы АТФ, т.к. не нужно тратить АТФ для получения глюкозо-6-фосфата. Первые девять реакций гликолиза представляют собой его эндергоническую (с поглощением энергии) фазу, а последние реакции — экзергоническую (с выделением энергии) фазу. В процессе гликолиза выделяется только около 7% теоретической энергии, которая может быть получена при полном окислении глюкозы (до СО2 и Н2О). Однако общая эффективность накопления энергии в форме АТФ составляет 35-40%, а в практических условиях клетки может быть и выше.
Глицеральдегидфосфатдегидрогеназа и лактатдегидрогеназа внутренне сопряжены (один требует НАД+, другой образует НАД+), что обеспечивает круговорот этого кофермента. В этом, возможно, заключается основное биохимическое значение терминальной дегидрогеназы.
Все реакции гликолиза обратимы, кроме 1, 5 и 13. Однако можно получить глюкозу (реакция 1) или фруктозомонофосфат (реакция 5) из их фосфорных производных при гидролитическом отщеплении фосфорной кислоты в присутствии соответствующих ферментов; реакция 13 практически необратима, по-видимому, вследствие высокой энергии гидролиза фосфорной группировки (около 13 ккал/моль). Поэтому образование глюкозы из продуктов гликолиза идет другим путем.
В присутствии O2 скорость гликолиза снижается (эффект Пастера). Есть примеры подавления гликолизом тканевого дыхания (эффект Кребтри) в некоторых интенсивно гликолизирующих тканях. Механизмы взаимоотношений анаэробных и аэробных окислительных процессов до конца не изучены. Одновременное регулирование процессов гликолиза и гликогенеза однозначно определяет поток углерода по каждому из этих путей в зависимости от нужд организма. Контроль осуществляется на двух уровнях — гормональном (у высших животных через регуляторные каскады с участием вторичных посредников) и метаболическом (у всех организмов).
Игорь Рапанович
Источник
ГЛИКО́ЛИЗ
ГЛИКО́ЛИЗ (от греч. γλυϰύς — сладкий и …лиз), ферментативный процесс анаэробного (протекающего без участия кислорода) расщепления глюкозы, сопровождающийся накоплением энергии, запасаемой в виде аденозинтрифосфата (АТФ). Широко распространён в природе, играет важную роль в метаболизме живых организмов. Г. лежит в основе разл. видов брожения. У облигатных анаэробных микроорганизмов, а также в некоторых клетках животных и человека (напр., зрелые эритроциты млекопитающих) Г. — единственный процесс, поставляющий энергию. В аэробных условиях у большинства организмов Г. предшествует окислительному распаду органич. соединений до СО2 и Н2О. У высших животных Г. интенсивно протекает в скелетных мышцах, печени, сердце, эритроцитах, сперматозоидах, быстро делящихся (в т. ч. опухолевых) клетках. Ферменты Г. локализованы в растворимой части цитоплазмы клеток.
Полная детальная расшифровка отд. реакций Г. была осуществлена гл. обр. благодаря работам немецких биохимиков Г. Эмбдена, О. Мейергофа, О. Варбурга, К. Нойберга, а также Я. О. Парнаса и К. Кори (1930-37). Иногда Г. называют «путём Эмбдена — Мейергофа — Парнаса».
Условно в процессе Г. выделяют две стадии. На первой (подготовительной) сначала происходит фосфорилирование глюкозы (реакция 1), катализируемое ферментом гексокиназой (иногда глюкокиназой) и требующее затраты энергии молекулы АТФ (см. схему). Образовавшийся глюкозо-6-фосфат при участии фермента фосфоглюкоизомеразы превращается (2) во фруктозо-6-фосфат, который в свою очередь фосфорилируется (для этого требуется ещё одна молекула АТФ) с помощью фосфофруктокиназы-1 (3) с образованием фруктозо-1,6-дифосфата. Последний с помощью фруктозо-1,6-дифосфатальдолазы (4) расщепляется до двух фосфотриоз: глицеральдегид-3-фосфата и дигидроксиацетонфосфата. Последний легко изомеризуется под действием триозофосфатизомеразы в глицеральдегид-3-фосфат (5). В дальнейшем используется только первое соединение. Т. о., из одной молекулы глюкозы на первой стадии Г. образуются две молекулы глицеральдегид-3-фосфата и при этом используется энергия двух молекул АТФ. На второй — осн. стадии Г. — глицеральдегид-3-фосфат претерпевает серию последовательных превращений, приводящих к образованию пировиноградной кислоты (ионизированная формула — пируват) и выделению энергии, аккумулируемой в виде АТФ. Сначала при участии фермента глицеральдегид-3-фосфатдегидрогеназы (6), в присутствии кофермента никотинамидадениндинуклеотида (НАД), который участвует в окислении альдегидной группы, переходя при этом в восстановленную форму (НАДН), и неорганического фосфата (Фн) происходит превращение глицеральдегид-3-фосфата в высокоэнергетическое соединение — 1,3-ди-фосфоглицерат. Затем в реакции т. н. субстратного фосфорилирования, которую осуществляет фермент фосфоглицераткиназа (7), происходит перенос фосфорильной группы с 1,3-дифосфоглицерата на аденозиндифосфат (АДФ) с образованием АТФ. Другой продукт этой реакции — 3-фосфоглицерат при участии фермента фосфоглицератмутазы (8) подвергается изомеризации в 2-фосфоглицерат. После этого в результате реакции отщепления молекулы воды, которую осуществляет фермент енолаза (9), происходит образование фосфоенолпирувата и в процессе ещё одной реакции субстратного фосфорилирования, которую катализирует фермент пируваткиназа (10), фосфорильная группа фосфоенолпирувата переносится на АДФ с образованием очередной молекулы АТФ. Следовательно, за вычетом затраченных на подготовительной стадии двух молекул АТФ в конечном итоге при распаде глюкозы образуются две молекулы АТФ.
Схема гликолиза.
Дальнейшая судьба образовавшегося пирувата и НАДН определяется особенностями метаболизма конкретных типов клеток и их обеспеченностью кислородом. В аэробных условиях пируват и восстановленные эквиваленты от НАДН (гидрид-ион) поступают в митохондрии, где происходит превращение пирувата в ацетил-КоА (см. Кофермент А), который поступает в трикарбоновых кислот цикл. В отсутствии кислорода НАДН используется на восстановление пирувата в лактат (ионизированная форма молочной кислоты). Это необходимо для получения НАД, без которого невозможно протекание глицеральдегид-3-фосфатдегидрогеназной реакции, а значит и всего Г. В молочнокислых бактериях, а также в белых мышцах (обеднённых митохондриями по сравнению с красными мышцами) лактат является конечным продуктом Г. У дрожжей пируват превращается в этанол (спиртовое брожение). Др. гексозы (галактоза, манноза, фруктоза), пентозы и глицерин могут включаться в Г. на разных его стадиях (напр., стадии 2, 3, 5). Поставщиком остатков глюкозы для нужд Г. у животных может также служить гликоген (в этом случае процесс называют гликогенолизом, он наиболее интенсивно протекает в мышцах), а у растений — крахмал, остатки глюкозы которых вовлекаются в Г. благодаря действию ферментов, приводящих к образованию сначала глюкозо-1-фосфата, а затем глюкозо-6-фосфата. В присутствии кислорода скорость Г. снижается в связи с началом процесса дыхания (эффект Пастера), которое обеспечивает более эффективный механизм образования богатых энергией связей. В опухолевых клетках, безъядерных эритроцитах, эмбриональных и некоторых других тканях эффект Пастера ослаблен или отсутствует вовсе (т. н. аэробный Г.).
Все реакции Г., за исключением 1, 3 и 10-й, обратимы. Ферменты, катализирующие эти три реакции, являются объектами сложной регуляции. Скорость Г. лимитирует фосфофруктокиназа-1. Этот фермент активируют фруктозо-2,6-дифосфат, АДФ и аденозинмонофосфат (АМФ), а ингибируют АТФ и цитрат (ионизированная форма лимонной кислоты). АТФ подавляет также активность гексокиназы и пируваткиназы. Образование мощного активатора Г. — фруктозо-2,6-дифосфата — из фруктозо-6-фосфата осуществляет особый фермент фосфофруктокиназа-2. Гормоны адреналин и глюкагон через систему внутриклеточной сигнализации, включающую образование циклического 3′,5′-аденозинмонофосфата (цАМФ) и активацию фермента протеинкиназы, вызывают фосфорилирование и инактивацию пируваткиназы в печени, но не в мышцах. Такая тканеспецифичная регуляция необходима для эффективного протекания глюконеогенеза в печени.
Установлено, что некоторым ферментам Г. свойствен ряд функций, не связанных с этим процессом. Напр., глицеральдегид-3-фосфатдегидрогеназа может переноситься в ядро и участвовать в индукции апоптоза, активируя процессы транскрипции.
Источник