Давление не изменяется какой процесс
Содержание статьи
материалы для подготовки к ЕГЭ по Физике
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: изопроцессы — изотермический, изохорный, изобарный процессы.
На протяжении этого листка мы будем придерживаться следующего предположения: масса и химический состав газа остаются неизменными. Иными словами, мы считаем, что:
• , то есть нет утечки газа из сосуда или, наоборот, притока газа в сосуд;
• , то есть частицы газа не испытывают каких-либо изменений (скажем, отсутствует диссоциация — распад молекул на атомы).
Эти два условия выполняются в очень многих физически интересных ситуациях (например, в простых моделях тепловых двигателей) и потому вполне заслуживают отдельного рассмотрения.
Если масса газа и его молярная масса фиксированы, то состояние газа определяется тремя макроскопическими параметрами: давлением, объёмом и температурой. Эти параметры связаны друг с другом уравнением состояния (уравнением Менделеева — Клапейрона).
Термодинамический процесс (или просто процесс) — это изменение состояния газа с течением времени. В ходе термодинамического процесса меняются значения макроскопических параметров — давления, объёма и температуры.
Особый интерес представляют изопроцессы — термодинамические процессы, в которых значение одного из макроскопических параметров остаётся неизменным. Поочерёдно фиксируя каждый из трёх параметров, мы получим три вида изопроцессов.
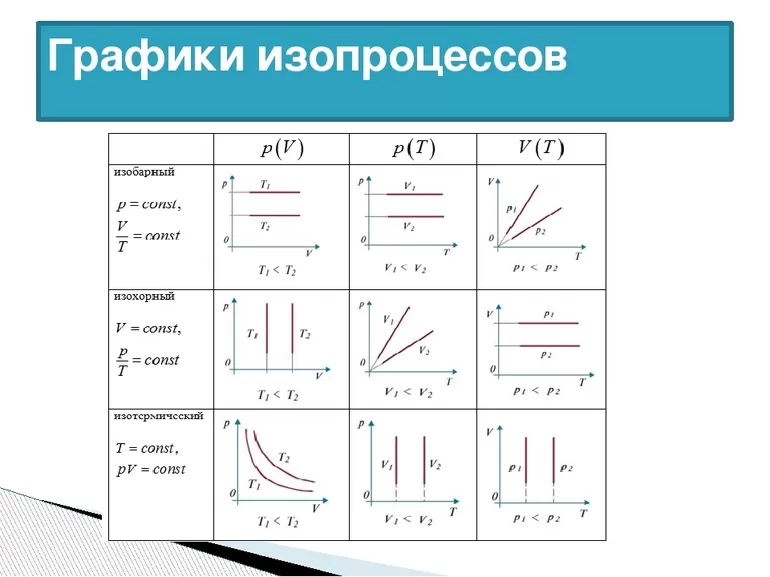
1. Изотермический процесс идёт при постоянной температуре газа: .
2. Изобарный процесс идёт при постоянном давлении газа: .
3. Изохорный процесс идёт при постоянном объёме газа: .
Изопроцессы описываются очень простыми законами Бойля — Мариотта, Гей-Люссака и Шарля. Давайте перейдём к их изучению.
Изотермический процесс
Пусть идеальный газ совершает изотермический процесс при температуре . В ходе процесса меняются только давление газа и его объём.
Рассмотрим два произвольных состояния газа: в одном из них значения макроскопических параметров равны , а во втором — . Эти значения связаны уравнением Менделеева-Клапейрона:
Как мы сказали с самого начала,масса и молярная масса предполагаются неизменными.
Поэтому правые части выписанных уравнений равны. Следовательно, равны и левые части:
(1)
Поскольку два состояния газа были выбраны произвольно, мы можем заключить, что в ходе изотермического процесса произведение давления газа на его объём остаётся постоянным:
(2)
Данное утверждение называется законом Бойля — Мариотта.
Записав закон Бойля — Мариотта в виде
(3)
можно дать и такую формулировку: в изотермическом процессе давление газа обратно пропорционально его объёму. Если, например, при изотермическом расширении газа его объём увеличивается в три раза, то давление газа при этом в три раза уменьшается.
Как объяснить обратную зависимость давления от объёма с физической точки зрения? При постоянной температуре остаётся неизменной средняя кинетическая энергия молекул газа, то есть, попросту говоря, не меняется сила ударов молекул о стенки сосуда. При увеличении объёма концентрация молекул уменьшается, и соответственно уменьшается число ударов молекул в единицу времени на единицу площади стенки — давление газа падает. Наоборот, при уменьшении объёма концентрация молекул возрастает, их удары сыпятся чаще и давление газа увеличивается.
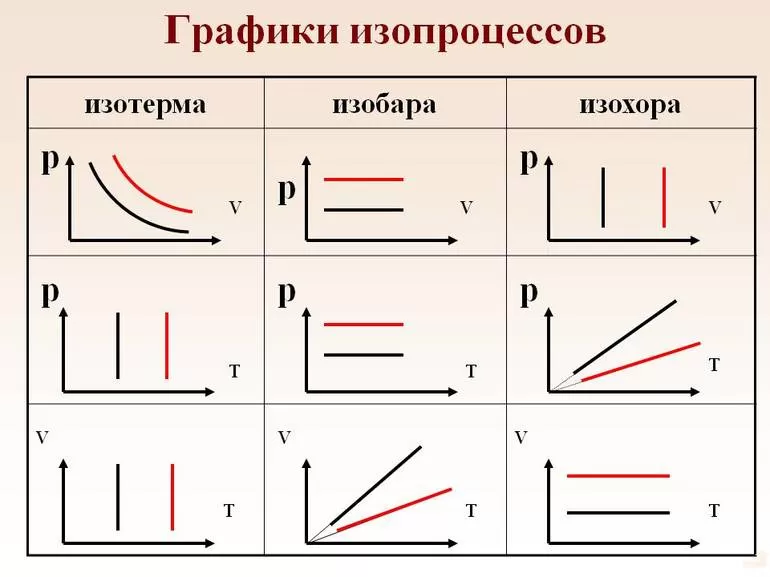
Графики изотермического процесса
Вообще, графики термодинамических процессов принято изображать в следующих системах координат:
• -диаграмма: ось абсцисс , ось ординат ;
• -диаграмма: ось абсцисс , ось ординат ;
• -диаграмма: ось абсцисс , ось ординат .
График изотермического процесса называется изотермой.
Изотерма на -диаграмме — это график обратно пропорциональной зависимости .
Такой график является гиперболой (вспомните алгебру — график функции ). Изотерма-гипербола изображена на рис. 1.

Рис. 1. Изотерма на -диаграмме
Каждая изотерма отвечает определённому фиксированному значению температуры. Оказывается, что чем выше температура, тем выше лежит соответствующая изотерма на —диаграмме.
В самом деле, рассмотрим два изотермических процесса, совершаемых одним и тем же газом (рис. 2). Первый процесс идёт при температуре , второй — при температуре .

Рис. 2. Чем выше температура, тем выше изотерма
Фиксируем некоторое значение объёма . На первой изотерме ему отвечает давление , на второй — . Но при фиксированном объёме давление тем больше, чем выше температура (молекулы начинают сильнее бить по стенкам). Значит, .
В оставшихся двух системах координат изотерма выглядит очень просто: это прямая, перпендикулярная оси (рис. 3):

Рис. 3. Изотермы на и -диаграммах
Изобарный процесс
Напомним ещё раз, что изобарный процесс — это процесс, проходящий при постоянном давлении. В ходе изобарного процесса меняются лишь объём газа и его температура.
Типичный пример изобарного процесса: газ находится под массивным поршнем, который может свободно перемещаться. Если масса поршня и поперечное сечение поршня , то давление газа всё время постоянно и равно
где — атмосферное давление.
Пусть идеальный газ совершает изобарный процесс при давлении . Снова рассмотрим два произвольных состояния газа; на этот раз значения макроскопических параметров будут равны и .
Выпишем уравнения состояния:
Поделив их друг на друга, получим:
В принципе, уже и этого могло бы быть достаточно, но мы пойдём немного дальше. Перепишем полученное соотношение так, чтобы в одной части фигурировали только параметры первого состояния, а в другой части — только параметры второго состояния (иными словами, «разнесём индексы» по разным частям):
(4)
А отсюда теперь — ввиду произвольности выбора состояний! — получаем закон Гей-Люссака:
(5)
Иными словами, при постоянном давлении газа его объём прямо пропорционален температуре:
(6)
Почему объём растёт с ростом температуры? При повышении температуры молекулы начинают бить сильнее и приподнимают поршень. При этом концентрация молекул падает, удары становятся реже, так что в итоге давление сохраняет прежнее значение.
Графики изобарного процесса
График изобарного процесса называется изобарой. На -диаграмме изобара является прямой линией (рис. 4):

Рис. 4. Изобара на -диаграмме
Пунктирный участок графика означает, что в случае реального газа при достаточно низких температурах модель идеального газа (а вместе с ней и закон Гей-Люссака) перестаёт работать. В самом деле, при снижении температуры частицы газа двигаются всё медленнее, и силы межмолекулярного взаимодействия оказывают всё более существенное влияние на их движение (аналогия: медленный мяч легче поймать, чем быстрый). Ну а при совсем уж низких температурах газы и вовсе превращаются в жидкости.
Разберёмся теперь, как меняется положение изобары при изменении давления. Оказывается, что чем больше давление, тем ниже идёт изобара на —диаграмме.
Чтобы убедиться в этом, рассмотрим две изобары с давлениями и (рис. 5):

Рис. 5. Чем ниже изобара, тем больше давление
Зафиксируем некоторое значение температуры . Мы видим, что . Но при фиксированной температуре объём тем меньше, чем больше давление (закон Бойля — Мариотта!).
Стало быть, .
В оставшихся двух системах координат изобара является прямой линией, перпендикулярной оси (рис. 6):

Рис. 6. Изобары на и -диаграммах
Изохорный процесс
Изохорный процесс, напомним, — это процесс, проходящий при постоянном объёме. При изохорном процессе меняются только давление газа и его температура.
Изохорный процесс представить себе очень просто: это процесс, идущий в жёстком сосуде фиксированного объёма (или в цилиндре под поршнем, когда поршень закреплён).
Пусть идеальный газ совершает изохорный процесс в сосуде объёмом . Опять-таки рассмотрим два произвольных состояния газа с параметрами и . Имеем:
Делим эти уравнения друг на друга:
Как и при выводе закона Гей-Люссака, «разносим» индексы в разные части:
(7)
Ввиду произвольности выбора состояний мы приходим к закону Шарля:
(8)
Иными словами, при постоянном объёме газа его давление прямо пропорционально температуре:
(9)
Увеличение давления газа фиксированного объёма при его нагревании — вещь совершенно очевидная с физической точки зрения. Вы сами легко это объясните.
Графики изохорного процесса
График изохорного процесса называется изохорой. На -диаграмме изохора является прямой линией (рис. 7):

Рис. 7. Изохора на -диаграмме
Смысл пунктирного участка тот же: неадекватность модели идеального газа при низких температурах.
Далее, чем больше объём, тем ниже идёт изохора на —диаграмме (рис. 8):

Рис. 8. Чем ниже изохора, тем больше объём
Доказательство аналогично предыдущему. Фиксируем температуру и видим, что . Но при фиксированной температуре давление тем меньше, чем больше объём (снова закон Бойля — Мариотта). Стало быть, .
В оставшихся двух системах координат изохора является прямой линией, перпендикулярной оси (рис. 9):

Рис. 9. Изохоры на и -диаграммах
Законы Бойля — Мариотта, Гей-Люссака и Шарля называются также газовыми законами.
Мы вывели газовые законы из уравнения Менделеева — Клапейрона. Но исторически всё было наоборот: газовые законы были установлены экспериментально, и намного раньше. Уравнение состояния появилось впоследствии как их обобщение.
Источник
Изопроцессы — виды графиков, формулы законов и уравнения
Трактовка понятий
Газ является одним из существующих агрегатных состояний вещества, для которого характерна слабая связь между компонентами и большая подвижность частиц. Последние передвигатся хаотично и свободно. При их столкновения изменяется характер движения.
Реальный газ считается высоко перегретым паром. Его свойства несколько отличаются от идеального компонента. В термодинамики различаются два состояния:
- насыщенные пары либо системы с двумя фазами;
- перегретые пары либо однофазовые системы.
Газы, как и жидкости, обладают текучестью. Они хорошо сопротивляются деформации. В отличие от воды, газ не имеет фиксированного объёма. Он стремится заполнить весь сосуд. Изопроцессы в газах подчиняются законам, которые определяют зависимость между двумя параметрами вещества при постоянном значении третьего. Так как уравнение справедливо для любой смеси, поэтому формула изотермического процесса (ИЗ) выражается следующим образом: T=const.
Само понятие ИЗ трактуется как новое состояние вещества, которое протекает при неизменной температуре. Процесс соответствует закону Бойля — Мариотта: для газа определённой массы произведение объёма на давление постоянно, если не изменяется температура. Равенство отображается на графике изопроцессов с помощью гиперболы и координат. Отдельно отмечаются изотермы при разных значениях температуры. В последнем случае соблюдается неравенство: Т1< Т2.
Другое понятие, характерное для Р газов — изобарный процесс. Состояние смеси изменяется, но количество давления остаётся постоянным. В сосуде могут происходить следующие явления:
- расширение;
- сжатие;
- охлаждение;
- нагревание.
Изобарный процесс подчиняется закону Гей-Люссака: для газовой смеси определённой массы отношение V/t постоянно, если Р не меняется. С математической точки зрения, графическое отображение явления является линейной зависимостью. На рисунке видны изобары для различных давлений газа, при этом соблюдается неравенство р1<р2.

Ещё одним примером состояния газа считается изохорный процесс. Его математический вид: V = const. Под явлением в физике подразумевается изменение состояние смеси, протекающее при постоянном V. Утверждения Шарля: для частиц определённой массы отношение P/t постоянно, если V const. Графически закон изопроцесса действует при разных объёмах.
Изопроцессы и уравнение состояния идеального газа впервые были описаны в работах молекулярного физика Клапейрона Эмиля. Он посвятил свои исследования теплоте, равновесию твёрдых объектов, пластичности. Эмиль первым оценил значение труда Карно. Ему удалось ввести в термодинамику графический способ, диаграммы.
Математические формулы
Состояние газовых масс характеризуется температурой, объёмом и давлением. С помощью уравнения формируется взаимосвязь между показателями. Формула используется в задачах по физике с целью изучения внутреннего теплового процесса. Главные параметры уравнения молекулярно-кинетической теории газовых веществ:
- р — давление, измеряется в паскалях, обозначается Па;
- m — масса (кг);
- n — концентрация молекул на определённом участке.
На уроках физике и на практике применяется несколько выражений для анализа состояния газа. При условии теплового равновесия используется уравнение Клайперона — Менделеева. Его составными показателями являются:
- р — давление;
- V — объём;
- Т — температура;
- m — масса;
- М — молярная масса, которая измеряется в кг/моль;
- R — считается универсальной постоянной, где k — постоянная Больцмана, а Na — постоянная Авогадро.
Значение двух последних показателей указано в специальных таблицах молекулярной физике. Если в задаче описан переход газовых веществ из одного состояния в другое, используется уравнение Клайперона. Для определённой массы газа произведение VP, делённое на абсолютную температуру, есть постоянная величина. Отдельно вычисляются параметры в момент 1 и 2.
Дополнительные выражения, которые используются для расчёта энергии, степени энтропии (неупорядоченность) и упорядоченности, концентрации и других показателей в молекулярно-кинетической теории (МКТ):
- Сокращенная формула состояния газа в идеальном виде. Для записи применяется постоянная Больцмана (k), концентрация молекул (n), температура газа (t).
- Формула плотности веществ. Её можно получить из главного уравнения.
- Закон Дальтона: давление газов из смеси равно сумме парциальных давлений всех газовых компонентов.
- Парциальное P. Используется для расписания состояния всех компонентов смеси и определения давления одного вещества, если бы оно занимало сосуд на 100%.
Дополнительные процессы

На практических занятиях по физике проводятся опыты с адиабатным или адиабатическим процессом (изоэнтропийный), связанным с термодинамикой. В явлении нет теплообмена с внешней средой. Чтобы наблюдать за общим случаем всех вышеописанных процессов, используется газ постоянной теплоёмкостью. Явление называется политропическим.
Если давление и температура составных компонентов одинаково, при этом они взяты в равных объёмах, тогда в используемых идеальных газах содержится одно число молекул. На долю одного моля разных веществ приходится N A =6,02·10 23молекул. Это считается числом Авогадро.
По закону Дальтона, давление смеси равно сумме парциальных P, входящих в состав. Выражение записывается следующим образом: P cm=P1+P2+…Pn. Последний показатель Pn является давлением газа, который бы занимал весь объёмом сосуда.
Чаще в старших классах физике рассматриваются изохорические процессы, когда переходит идеальный газ из одного состояния в другое, при этом не изменяется его объёмом. Явление впервые рассмотрел француз Жак Шарль. Закон записывается следующим образом: PV=vRT. Так как v= const и V=const, поэтому для любых разных состояний веществ используется равенство: P1/T1=P2/T2=….Pn/Tn. Закон Шарля математически записывается так: P/T=const.
Из выражения следует, что между температурой и давлением наблюдается прямо пропорциональная связь. Если увеличивается P, тогда повышается T, и наоборот. График зависимости данных величин называется изохорой. На промежутке абсолютного нуля для кривых предусмотрена условная зависимость. Прямая доводится до начала координат с помощью пунктирных линий.
Подобная зависимость T от P и V при изобарных и изохорных процессах определяет точность и эффективность измерения температуры газовыми термометрами. Первыми ученые открыли эти явления, которые считаются частными случаями уравнения состояния. Позже физики утвердили закон Клапейрона и Менделеева.
Если следовать хронологии, сначала изучались процессы, которые протекали при постоянной температуре, а затем при одном объеме. Последними рассматривались изобарические процессы. Редким и интересным явлением считается изоэнтропия, когда изменяется термодинамическая система при условии постоянной энтропии. Последнее записывается как S=const.
Примером подобного считается адиабатический обратимый процесс. Чтобы вычислить идеальный газ, используется уравнение: pVγ = const, где γ — показатель адиабаты (определяется типом газа). Для адиабатического явления характерно отсутствие теплоприёма и теплоотдачи. Физики считают такие процессы быстро протекающими.
Источник
Изопроцессы | LAMPA — платформа для публикации учебных материалов
Новая тема. И названа она каким-то непонятным словом: изопроцессы. На самом деле – всё не так и сложно. По сути, тема «изопроцессов» – это продолжение темы «Уравнение Клапейрона-Менделеева». В этом разделе будет идти речь о том, как применять уравнение Клапейрона-Менделеева pV=mMRTpV = frac{m}{M}RTpV=MmRT. Вы можете спросить: «Тогда зачем называть тему таким странным словом – «изопроцессы»? Лучше назвали бы её просто «Применение уравнения Клапейрона-Менделеева к решению задач». Это хороший вопрос. Попробуем разобрать само слово «изопроцессы»:
- «изо» – от древнегреческого слова isos – что значит «одинаковый»;
- процесс – значит, что-то происходит, что-то меняется.
Итак, изопроцесс – это процесс изменения чего-то, но при этом изменении что-то другое остаётся неизменным. Что же не меняется в изопроцессах?
В уравнение Клапейрона-Менделеева pV=mMRTpV = frac{m}{M}RTpV=MmRT входят три величины, которые могут изменяться:
- давление газа ppp;
- объём газа VVV;
- температура газа TTT.
Если какая-то из этих величин не меняется, в то время как две другие величины меняются – то мы имеем дело с «изопроцессом».
При этом предполагается, что масса mmm газа в уравнении pV=mMRTpV = frac{m}{M}RTpV=MmRT неизменна: то есть газ «не утекает» из сосуда, но никто его в сосуд и «не добавляет».
Существует три типа изопроцессов:
- не меняется давление газа ppp – изобарный процесс: p=constp = constp=const.
- не меняется объём газа VVV – изохорный процесс: V=constV = constV=const.
- не меняется температура газа TTT – изотермический процесс: T=constT = constT=const.
Почему одна из величин не изменяется, зачем это нужно? Дело в том, что анализировать процесс, следить за процессом, в котором изменяются сразу три величины (давление газа ppp, объём газа VVV и температура TTT) очень непросто. Мы привыкли к тому, что изменяются две величины. Ну, например, в математике. Вспомните функции в математике. Например, квадратичную функцию: y=x2y = x^2y=x2. Меняется xxx – и мы видим, как меняется yyy. Например, если xxx увеличился в 222 раза, то yyy увеличится в 444 раза. Если бы менялись сразу две величины – не только xxx, но и какая-нибудь величина zzz, то «следить» за тем, что происходило бы с yyy, было бы значительно сложнее.
Поэтому особое значение имеют процессы, в которых что-то неизменно, то есть процессы с одной постоянной величиной – «изопроцессы». В таких процессах меньше «хаоса» и «непонятности».
Разберём каждый из изопроцессов подробнее. Для наглядности будем рассматривать сосуд с некоторым газом – например, гелием. В верхней части сосуда – пусть будет поршень, который мы можем двигать или который может двигаться самостоятельно.
1. Изобарный процесс: p=constp = constp=const.
При изобарном процессе неизменно давление.
Как в реальности можно сделать так, чтобы давление газа не изменялось? (Учтите, что правильным является только один вариант ответа.)
Держать газ при постоянной температуре; не давать ему охлаждаться и нагреваться.
Держать газ в плотно закрытой ёмкости, объём которой неизменен.
Поместить газ под поршень постоянной массы, который может свободно двигаться.
Изобарный процесс – это идеализация; в реальности сделать его невозможно.
Представим, что мы нагрели наш газ, находящийся под поршнем – то есть находящийся при постоянном давлении. Пусть исходное состояние обозначается цифрой 111, а конечное – цифрой 222.
Тогда для первого состояния мы можем записать: pV1=mMRT1pV_1 = frac{m}{M}RT_1pV1=MmRT1.
А для второго: pV2=mMRT2pV_2 = frac{m}{M}RT_2pV2=MmRT2.
Поделим второе равенство на первое.
Как вы думаете, что мы получим при делении второго равенства на первое?
V2V1=T1T2frac{V_2}{V_1} = frac{T_1}{T_2}V1V2=T2T1
V1V2=T2T1frac{V_1}{V_2} = frac{T_2}{T_1}V2V1=T1T2
V2⋅V1=T2⋅T1V_2 cdot V_1 = T_2 cdot T_1V2⋅V1=T2⋅T1
V2V1=T2T1frac{V_2}{V_1} = frac{T_2}{T_1}V1V2=T1T2
При p=constp = constp=constV2V1=T2T1frac{V_2}{V_1} = frac{T_2}{T_1}V1V2=T1T2
Что означает формула V2V1=T2T1frac{V_2}{V_1} = frac{T_2}{T_1}V1V2=T1T2? Как её использовать? Попробуйте ответить на следующий вопрос: если температура во втором состоянии станет в 222 раза больше, чем в первом состоянии, то во сколько раз и как изменится объём?
Как изменится объём газа в изобарном процессе, если температура увеличится в два раза?
Не изменится.
Уменьшится в 222 раза.
Увеличится в 222 раза.
Однозначно ответить на этот вопрос нельзя.
Мы узнали, что при изобарном процессе во сколько раз увеличивается температура газа – во столько же раз увеличивается и объём газа. Графически это изображается следующим образом:
Прямая пропорциональная зависимость.
Два ученика, желая привести примеры изобарного процесса, изобразили графики зависимости объёма VVV идеального газа от его абсолютной температуры TTT. Эти графики показаны на рисунках А и Б.
Какой из рисунков является правильным?
(Источник: ЕГЭ-2013. Физика. Диагностическая работа 2 от 21.03.2013)
Только А.
Только Б.
И А, и Б.
Ни А, ни Б.
2. Изохорный процесс: V=constV = constV=const.
Изохорный процесс – это процесс, при котором объём газа остаётся постоянным, неизменным.
Интересно, а как можно было бы осуществить изохорный процесс с газом в цилиндре под поршнем? Попробуйте предположить.
Держать газ при постоянной температуре: не охлаждать и не нагревать.
Держать газ под поршнем постоянной массы, который мог бы свободно перемещаться в цилиндре.
Жёстко зафиксировать поршень так, чтобы размеры и форма сосуда с газом практически не менялись.
Изохорный процесс в реальности не осуществим; изохорный процесс – это некоторая идеализация.
Представим, что мы нагрели газ неизменного объёма (V=constV = constV=const). Температура увеличилась, и газ при этом перешёл из первого состояния во второе. Для каждого из двух состояний мы можем записать следующее:
p1V=mMRT1p_1V = frac{m}{M}RT_1p1V=MmRT1 – для первого состояния;
p2V=mMRT2p_2V = frac{m}{M}RT_2p2V=MmRT2 – для второго состояния.
Поделим уравнение для второго состояния на уравнение для первого состояния.
Как вы думаете, какое соотношение мы получим, поделив уравнение для второго состояния на уравнение для первого состояния?
p2p1=T1T2frac{p_2}{p_1} = frac{T_1}{T_2}p1p2=T2T1
p1p2=T2T1frac{p_1}{p_2} = frac{T_2}{T_1}p2p1=T1T2
p2⋅p1=T2⋅T1p_2 cdot p_1 = T_2 cdot T_1p2⋅p1=T2⋅T1
p2p1=T2T1frac{p_2}{p_1} = frac{T_2}{T_1}p1p2=T1T2
При V=constV = constV=constp2p1=T2T1frac{p_2}{p_1} = frac{T_2}{T_1}p1p2=T1T2
Как можно использовать формулу p2p1=T2T1frac{p_2}{p_1} = frac{T_2}{T_1}p1p2=T1T2, как её понять? Допустим, что температура увеличилась вдвое: T2=2T1T_2 = 2T_1T2=2T1.
Как изменилось давление при изохорном процессе, если температура увеличилась в два раза?
Не изменилось.
Увеличилось в 222 раза.
Уменьшилось в 222 раза.
Ответить на этот вопрос невозможно.
Таким образом, если в изохорном процессе температура газа увеличивается в 222 раза, то и давление газа увеличивается в 222 раза.
В более общей форме можно записать: в изохорном процессе (когда объём газа не изменяется) во сколько раз увеличивается температура – во столько же раз увеличивается и давление газа. Графически в координатах p…Tp…Tp…T этот процесс изображается прямой линией – прямой пропорциональностью:
Идеальный газ находится в сосуде постоянного объёма. На рисунке приведён график зависимости средней кинетической энергии EEE хаотического движения молекул газа от времени ttt.
На каком из рисунков правильно показана зависимость давления ppp газа от времени?
(Источник: ЕГЭ-2013. Физика. Диагностическая работа 2 от 21.03.2013)
111
222
333
444
3. Изотермический процесс: T=constT = constT=const.
Изотермический процесс – это процесс, при котором температура газа не изменяется.
Интересно, а можно в реальности сделать некоторый процесс изотермическим; и если можно – то как это сделать?
Зафиксировать поршень над газом: зафиксировать форму и размеры сосуда с газом.
Держать газ под поршнем, который может двигаться свободно и при этом имеет одну и ту же массу.
Поместить ёмкость с газом в очень большой сосуд с веществом определённой температуры.
Изотермический процесс – это абстракция, и в реальности его осуществить невозможно даже приблизительно.
Попробуем получить некоторую формулу, которая бы как-то описывала изотермический процесс. Представим, что у нас газ перешёл из состояния 111 в состояние 222. При этом температура его не изменилась. Тогда, используя уравнение Клапейрона- Менделеева, мы можем записать:
- для состояния 111: p1V1=mMRTp_1V_1 = frac{m}{M}RTp1V1=MmRT;
- для состояния 222: p2V2=mMRTp_2V_2 = frac{m}{M}RTp2V2=MmRT.
Мы можем приравнять левые части этих равенств: p1V1=p2V2p_1V_1 = p_2V_2p1V1=p2V2.
При T=constT = constT=constp1V1=p2V2p_1V_1 = p_2V_2p1V1=p2V2
Как можно использовать это равенство? Давайте для этого рассмотрим пример. Представим, что объём газа изотермически увеличился в два раза: V2=2V1V_2 = 2V_1V2=2V1.
Как вы думаете, как изменилось давление газа при изотермическом процессе, если его объём увеличился в два раза?
Увеличилось в 222 раза.
Уменьшилось в 222 раза.
Не изменилось.
Ответить на этот вопрос нельзя – не хватает данных
Итак, мы убедились в том, что при увеличении объёма VVV в несколько раз – должно уменьшиться в это же число раз давление ppp. И наоборот: при уменьшении объёма VVV во столько же раз должно увеличиться и давление ppp. Для наглядности можно даже получить некоторую зависимость. Из уравнения Клапейрона-Менделеева:
pV=mMRT⇒p=[mMRT]VpV = frac{m}{M}RT Rightarrow p = frac{[frac{m}{M}RT]}{V}pV=MmRT⇒p=V[MmRT].
Хм… что-то похожее было в математике.
На какую функцию похоже выражение p=[mMRT]Vp = frac{[frac{m}{M}RT]}{V}p=V[MmRT]?
На прямую пропорциональность: y=k⋅xy = k cdot xy=k⋅x.
На обратную пропорциональность: y=kxy = frac{k}{x}y=xk.
На квадратичную функцию: y=a⋅x2y = a cdot x^2y=a⋅x2.
На тригонометрическую функцию.
Как вы думаете, какой тогда график в координатах p…Vp…Vp…V соответствует изотермическому процессу?
111
222
333
444
Итак, в изотермическом процессе объём VVV и давление ppp связаны обратной пропорциональной зависимостью.
Решим задачу.
Условие
При переводе идеального газа из состояния 111 в состояние 222 концентрация молекул nnn пропорциональна давлению ppp (см. рисунок). Масса газа в процессе остаётся постоянной.
Утверждается, что в данном процессе
А. плотность газа возрастает.
Б. происходит изотермическое расширение газа.
Из этих утверждений
- верно только А.
- верно только Б.
- оба верны.
- оба неверны.
(Источник: ЕГЭ-2013. Физика. Реальный экзамен. Сибирь)
Решение
Шаг 1. Попробуем проверить истинность первого утверждения про плотность газа.
Связана ли плотность напрямую с какой-либо из величин: давлением или концентрацией?
Не связана ни с одной из этих величин.
Связана напрямую с концентрацией.
Связана напрямую с давлением.
Связана напрямую с некоторой другой величиной, которая на графике не отражена.
Шаг 2. Поймем, как менялась плотность газа при переходе из состояния 111 в состояние 222. Это поможет нам подтвердить или опровергнуть утверждение А.
Что вы можете сказать об изменении плотности газа, воспользовавшись графиком, который приведён в условии задачи?
Плотность увеличивается.
Плотность не изменяется.
Плотность уменьшается.
Ответить на вопрос задачи – невозможно, мало данных.
Шаг 3. На графике оси подписаны как давление ppp и концентрация nnn. Есть ли у нас формула, которая бы связывала эти две величины?
Существует ли у формула, которая связывает давление и концентрацию? Если такая формула существует, то как она выглядит?
Нет, такой формулы нет.
Есть: T=pnkT = pnkT=pnk.
Есть: p=nkTp = nkTp=nkT.
Есть: pk=nTpk = nTpk=nT.
Шаг 4. Из графика мы видим, что давление ppp и концентрация nnn связаны прямой пропорциональностью: во сколько раз уменьшается давление – во столько же раз уменьшается и концентрация молекул.
Как вы думаете, что при этом происходит с температурой?
Температура увеличивается.
Температура остаётся неизменной.
Температура уменьшается.
Однозначно ответить на вопрос задачи нельзя – не хватает данных.
Шаг 5. В утверждении Б говорится не только про то, что процесс изотермический, но и про то, что происходит расширение газа – то есть объём газа должен увеличиться.
Связан ли объём с какой-либо из упомянутых в этой задаче величин? Отметьте все верные высказывания.
Да, связан – с концентрацией.
Да, связан – с давлением.
Да, связан – с постоянной Больцмана.
Нет, ни с чем не связан.
Вспомните формулу для концентрации:
Составьте правильную формулу.
Мы знаем, что концентрации в задаче – уменьшается. Это значит, что объём – должен увеличиваться: происходит изотермическое расширение газа. Утверждение Б – верное.
Правильный ответ: 2) верно только Б.
Задачи для самостоятельного решения: #изопроцессы
Источник